Dec. 3 WEBINAR | Leveraging Embase AI in life science research with Dr. Vassiki Sanogo and Regina Maxwell, MLIS

Infelizmente, não oferecemos suporte total ao seu navegador. Se for possível, atualize para uma versão mais recente ou use o Mozilla Firefox, o Microsoft Edge, o Google Chrome ou o Safari 14 ou mais recente. Se não conseguir e precisar de suporte, envie seu feedback.
Gostaríamos de receber seu feedback sobre essa nova experiência.Diga-nos sua opinião
Estão faltando informações críticas para a conformidade e o desenvolvimento de dispositivos médicos? A Embase fornece pesquisas direcionadas à literatura de dispositivos médicos por meio de ampla cobertura de conteúdo, indexação precisa e termos específicos do dispositivo.
Entre em contato conosco sobre a Embase para dispositivos médicos


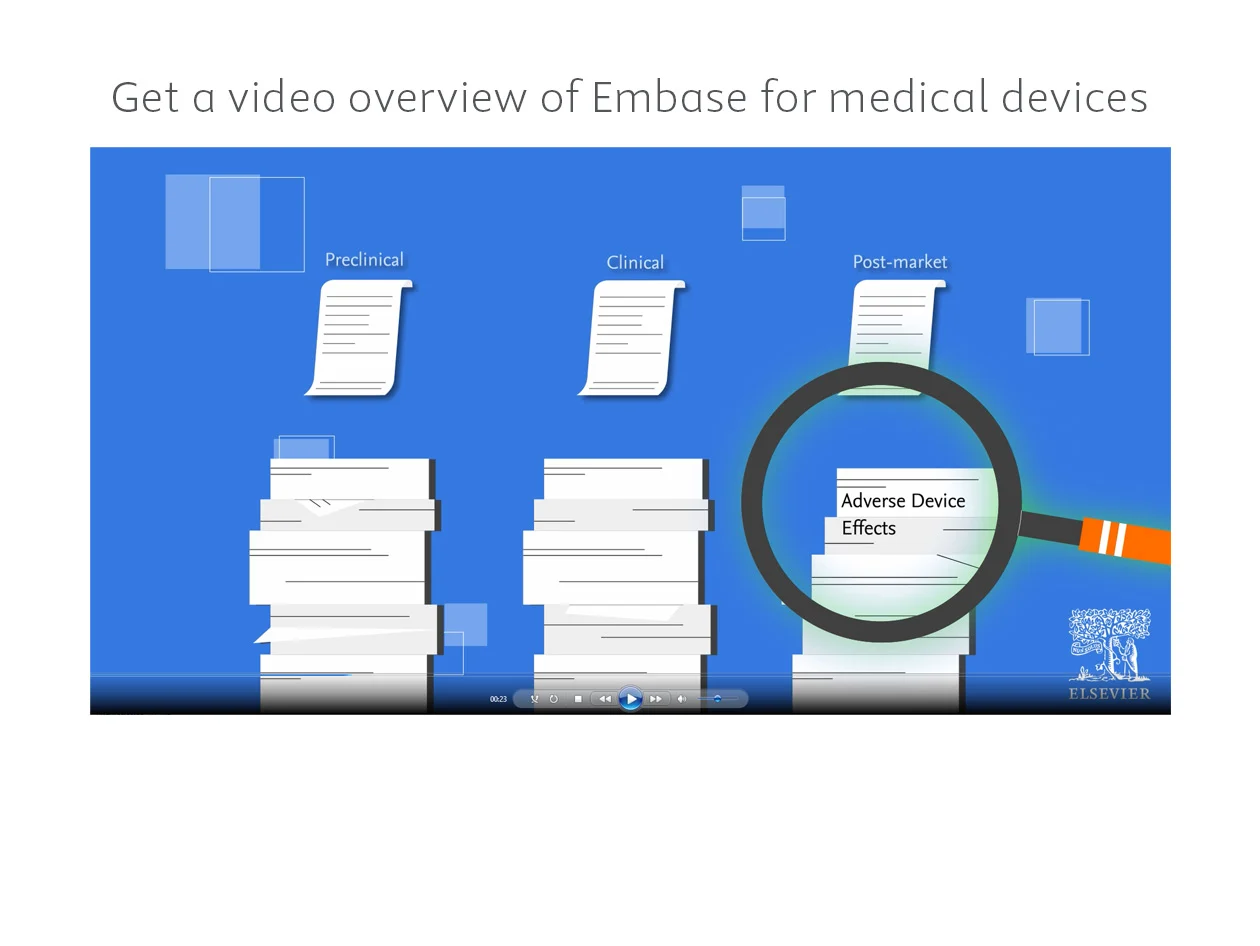
Watch now
|
A Embase tem as ferramentas de pesquisa, evidência e monitoramento de literatura de dispositivos médicos para ajudá-lo a:
Desenvolver e validar novos conceitos
Cumprir as regulamentações de dispositivos médicos
Preparar relatórios de avaliação clínica para aprovação CE Marketing
Realizar vigilância pós-comercialização

O Embase elimina a dificuldade de criar as complexas cadeias de caracteres de pesquisa necessárias para pesquisas de alta recuperação e alta precisão. Um formulário de pesquisa de dispositivos médicos e termos predefinidos eliminam a adivinhação da pesquisa.

Nossa equipe indexa manualmente artigos de texto completo, para que você possa pesquisar por dispositivo, conceito, fabricante, procedimento, nome comercial do dispositivo, termos da Global Medical Device Nomenclature (GMDN) aprovados pela FDA e muito mais.
Os alertas por e-mail garantem que você receba as informações mais recentes publicadas, incluindo preprints e anais de conferências.

A falta de uma pesquisa SOTA é uma das principais razões para os achados de não conformidade MDR/IVDR.
Use o comando de pesquisa do Embase para manter-se atualizado com o conteúdo SOTA relevante de acordo com as diretrizes regulatórias.
Para que os MDR estejam em conformidade, as bases de dados devem demonstrar um alcance europeu suficiente.
Embase cobre todo o conteúdo contido no MEDLINE e tem cobertura única para a Europa, incluindo resumos de conferências e revistas europeias.
Uma das coisas mais incríveis do Embase é que todo o artigo é indexado para termos e nomes de produtos. Para dispositivos médicos, poder localizar informações sobre um produto específico é uma grande vantagem.
Dawn McMillen
Supervisora de recursos de biblioteca em Stryker Orthopedics
