Dec. 3 WEBINAR | Leveraging Embase AI in life science research with Dr. Vassiki Sanogo and Regina Maxwell, MLIS

Leider unterstützen wir Ihren Browser nicht vollständig. Wenn Sie die Möglichkeit dazu haben, nehmen Sie bitte ein Upgrade auf eine neuere Version vor oder verwenden Sie Mozilla Firefox, Microsoft Edge, Google Chrome oder Safari 14 bzw. eine neuere Version. Wenn Sie nicht dazu in der Lage sind und Unterstützung benötigen, senden Sie uns bitte Ihr Feedback.
Wir würden uns über Ihr Feedback zu diesen neuen Seiten freuen.Sagen Sie uns, was Sie denken
Fehlen Ihnen wichtige Informationen für die Konformität und Entwicklung von Medizinprodukten? Embase bietet gezielte Literaturrecherchen zu Medizinprodukten durch eine breite Inhaltsabdeckung, präzise Indexierung und gerätespezifische Begriffe.


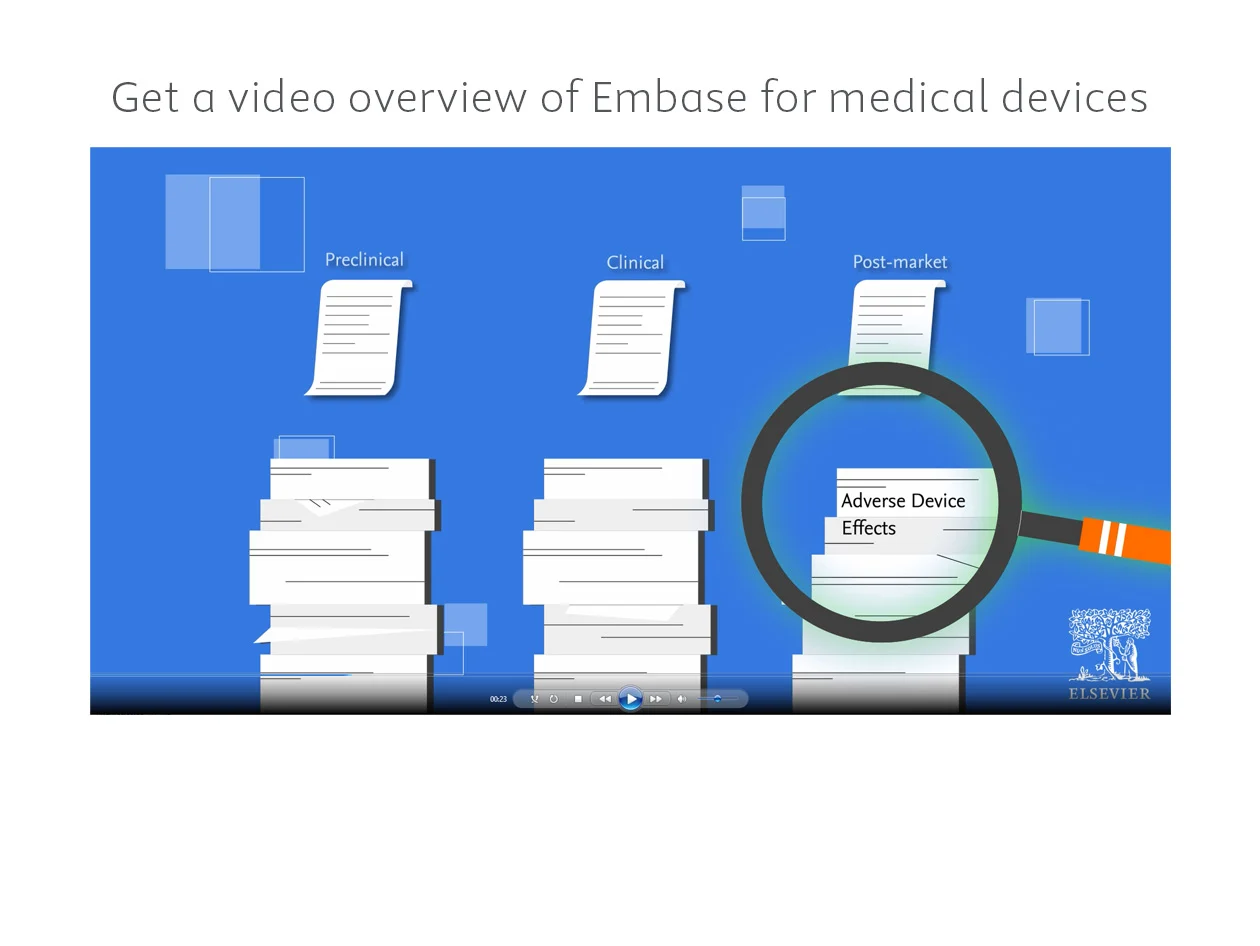
Jetzt ansehen
|
Embase verfügt über die Tools zur Recherche, Evidenz und Literaturüberwachung von Medizinprodukten, die Ihnen helfen:
Entwicklung und Validierung neuer Konzepte
Vorschriften für Medizinprodukte einhalten
Erstellung von klinischen Bewertungsberichten für die CE-Marktzulassung
Durchführung von Überwachungen nach dem Inverkehrbringen

Embase macht es Ihnen leicht, die komplexen Suchzeichenfolgen zu erstellen, die für hochpräzise Suchvorgänge mit hoher Erinnerungsrate erforderlich sind. Ein Suchformular für medizinische Geräte und voreingestellte Begriffe machen Schluss mit dem Rätselraten bei der Suche.

Unser Team indiziert Volltextartikel manuell, sodass Sie nach Gerät, Konzept, Hersteller, Verfahren, Handelsname des Geräts, von der FDA zugelassenen Begriffen der Global Medical Device Nomenclature (GMDN) und mehr suchen können.
E-Mail-Benachrichtigungen stellen sicher, dass Sie die neuesten veröffentlichten Informationen erhalten, einschließlich Preprints und Konferenzberichte.

Das Fehlen einer SOTA-Suche ist einer der Hauptgründe für MDR/IVDR-Nichtkonformitätsbefunde.
Verwenden Sie den Suchbefehl von Embase, um sich in Übereinstimmung mit den behördlichen Richtlinien über relevante SOTA-Inhalte auf dem Laufenden zu halten.
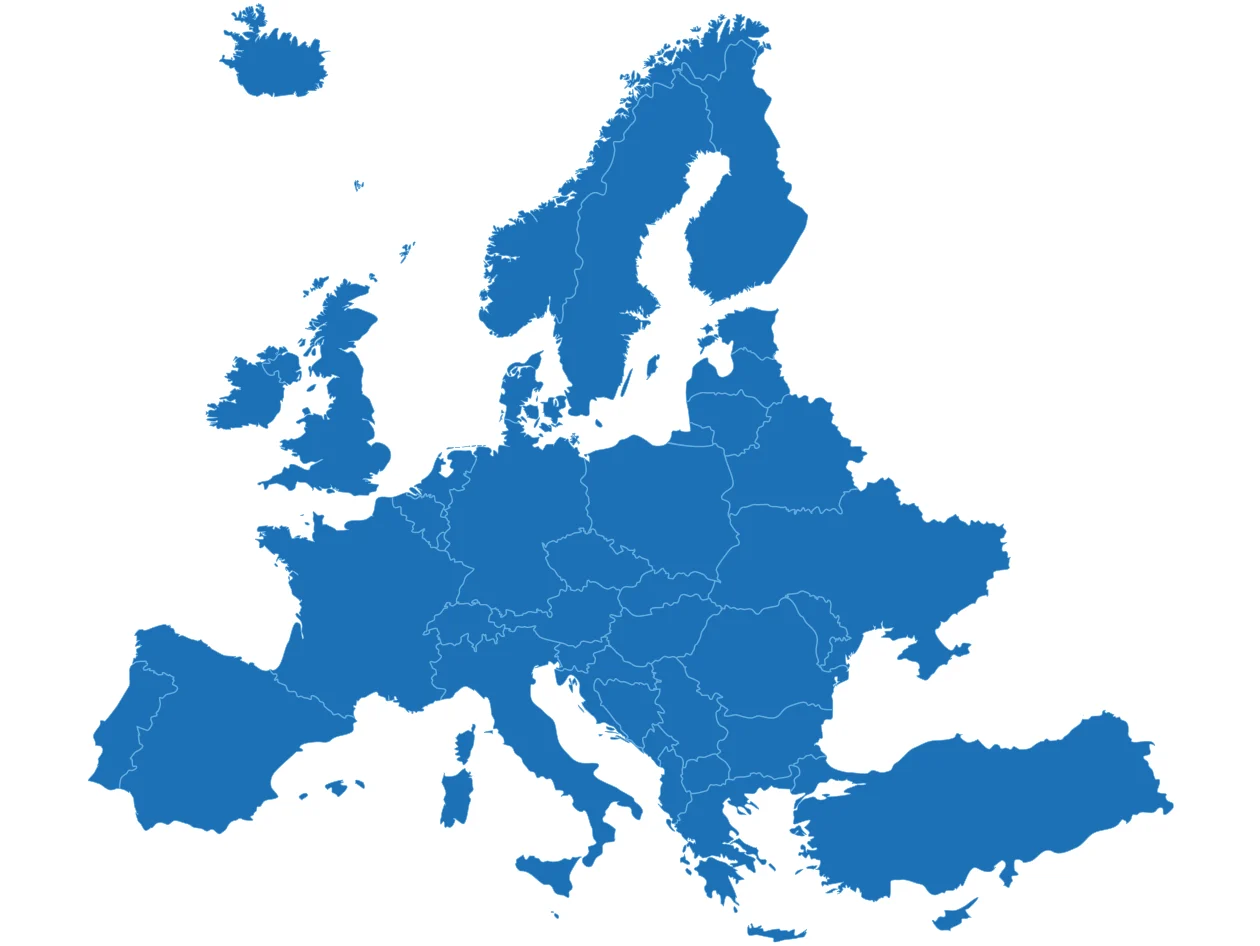
Für die MDR-Konformität müssen Datenbanken eine ausreichende europäische Reichweite aufweisen.
Embase deckt alle in MEDLINE enthaltenen Inhalte ab und bietet eine einzigartige Abdeckung für Europa, einschließlich Konferenz-Abstracts und europäischer Zeitschriften.
„In Embase ist der gesamte Artikel nach Begriffen und Produktbezeichnungen indexiert. Bei Medizinprodukten ist es ein großes Plus, nach Informationen zu einem bestimmten Produkt suchen zu können.
Dawn McMillen
Library Resources Supervisor bei Stryker Orthopedics
