Neurophysiologie, dans une optique clinique
France | 14 septembre 2025

Neurophysiologie : le meilleur ouvrage pour maîtriser et être à la pointe de la neurophysiologie dans une optique clinique, par les experts dans le domaine.
Toutes nos publications sont sur elsevier-masson.fr
Le manuel Neurophysiologie expose les connaissances actuelles dans une optique clinique en 6 parties : Neurones, Régulations endogènes, Systèmes sensoriels, Système moteur, Dynamique des activités cérébrales et Fonctions supérieures.
Voici la liste de tous les chapitres
Prologue - L'organisation générale du système nerveux / Partie 1 - Neurones : 1. Les neurones et les cellules gliales ; 2. Le fonctionnement du neurone ; 3. Les synapses du système nerveux central ; 4. Les circuits et réseaux de neurones, codage neuronal, bruit / Partie 2 - Régulations endogènes : 5. Le liquide céphalorachidien ; 6. Le débit sanguin cérébral ; 7. Le contrôle de l'homéostasie ; 8. Le système nerveux végétatif ou "autonome" / Partie 3 - Systèmes sensoriels : 9. La somesthésie ; 10. La douleur-la nociception ; 11. Le système auditif ; 12. Le système vestibulaire ; 13. Le système visuel ; 14. Le système gustatif ; 15. Le système olfactif / Partie 4 - Système moteur : 16. La motricité ; 17. Les réflexes spinaux ; 18. Le contrôle de la posture par le tronc cérébral et le vestibule ; 19. La locomotion ; 20. La motricité volontaire ; 21. Le contrôle de la motricité volontaire par le cervelet et les ganglions de la base / Partie 5 - Dynamique des activités cérébrales : 22. Exploration de la dynamique cérébrale : l'électroencéphalographie ; 23. Le sommeil / Partie 6 - Fonctions supérieures : 24. Neurophysiologie de la conscience ; 25. Le langage ; 26. La mémoire ; 27. Les émotions 28. Sexualité. Annexe : XNBC. Glossaire
Nous vous proposons de découvrir le chapitre 5 Le liquide céphalorachidien de la Partie 2 Régulations endogènes.
Chapitre 5
Le liquide céphalorachidien
Jean-François Vibert, Gilles Huberfeld
PLAN DU CHAPITRE
Rappel anatomique Composition du liquide céphalorachidien Production du liquide céphalorachidien Circulation du liquide céphalorachidien Pression du liquide céphalorachidien Rôle du liquide céphalorachidien Barrières méningées Exploration du liquide céphalorachidien Système glymphatique
Le liquide céphalorachidien ou LCR (appelé en anglais cerebrospinal fluid [CSF]) constitue une des parties du compartiment extracellulaire. L’examen du LCR étant un acte important de la médecine courante, il est essentiel d’avoir une idée claire de son anatomie et de sa physiologie.
Rappel anatomique
Le système nerveux central (SNC) est enveloppé par les méninges qui sont, de dehors en dedans, la dure-mère, l’arachnoïde et la pie-mère (figure 5.1). La dure-mère est constituée par un tissu fibreux bordé par un endothélium. C’est la seule partie du cerveau qui contienne des récepteurs à la douleur. Entre la dure-mère et l’arachnoïde, qui ne pénètre pas dans les sillons, on trouve l’espace sous-dural qui contient une petite quantité de liquide ressemblant à de la lymphe. La dernière méninge, la pie-mère, pénètre dans les sillons. C’est entre la pie-mère et l’arachnoïde que se trouve le LCR, soit 150 cm3 dans l’espace sous-arachnoïdien (figure 5.1). La dure-mère se termine au niveau de la deuxième vertèbre sacrée, alors que l’extrémité inférieure de la moelle se trouve à la hauteur de la première vertèbre lombaire. L’enveloppe médullaire peut donc être ponctionnée au niveau de la région lombaire basse, sans risque de provoquer une lésion médullaire. C’est là qu’on prélève le LCR par ponction lombaire (PL), au-dessous de L1 et du cône terminal de la moelle.
Figure 5.1 Dure-mère (pie mère et substance blanche) au niveau médullaire (x40). Moelle humaine, trichrome de Masson modifié Goldner. Avec l’aimable autorisation du Dr N. Maurin, laboratoire d’histologie, faculté de médecine P. et M. Curie, site Saint-Antoine, UPMC, Paris.
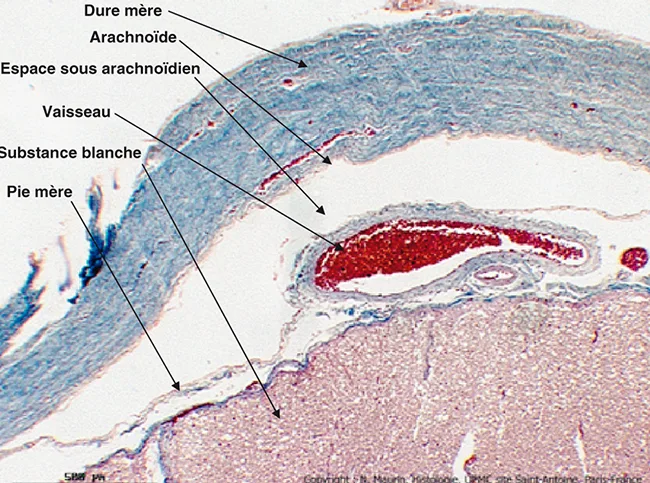
Figure 5.1
Le LCR se trouve donc à l’extérieur du SNC où il forme des citernes (figure 5.2) :
grande citerne sous le cervelet ;
citerne basilaire qui contient l’artère basilaire ;
citerne interpédonculaire qui contient le polygone de Willis.
Figure 5.2 Coupe sagittale médiane de la tête, montrant la disposition de l’encéphale et des méninges. Source : Crossman AR, Neary D. Neuroanatomie. Trad. fr. coordonnée par J.-F. Vibert. Paris : Elsevier SAS (coll. Campus Illustré) ; 2004.
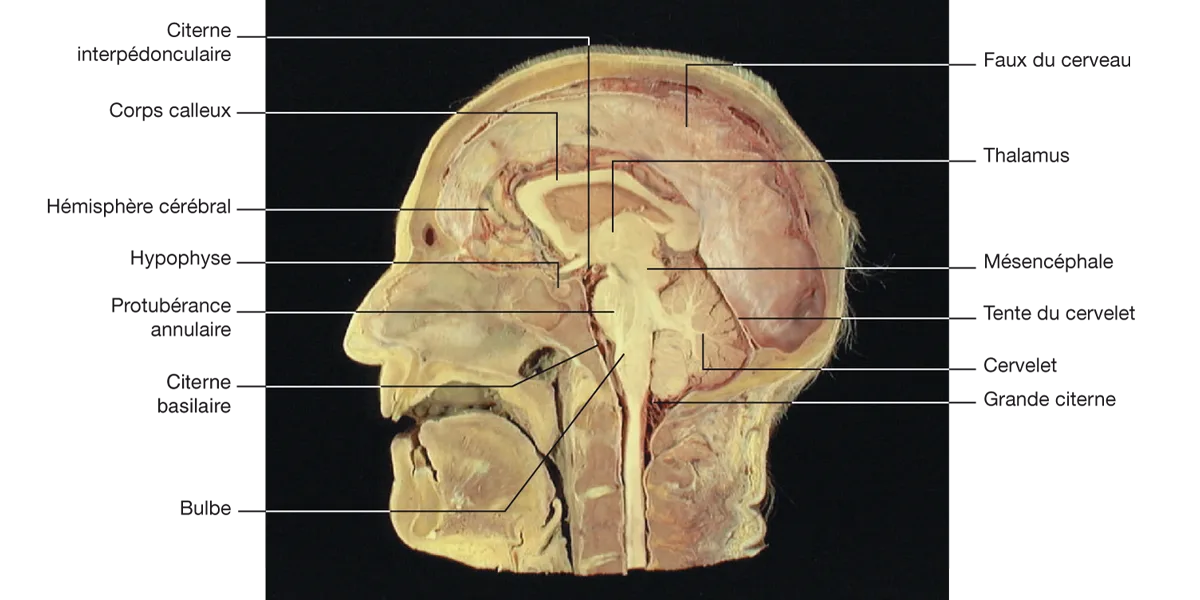
Figure 5.2
Mais le LCR se trouve aussi à l’intérieur du SNC (figure 5.3), dans les ventricules V1 et V2 qui communiquent avec V3 par les trous de Monro, et dans V4 qui est relié à V3 par l’aqueduc de Sylvius. V4 communique avec l’extérieur par le foramen de Magendie médian et les foramens de Luschka latéraux. Dans ces cavités, il n’y a que la pie-mère comme méninge, il n’y a pas d’arachnoïde.
Ainsi le LCR peut-il et doit-il circuler librement de l’intérieur à l’extérieur du SNC.
Une des fonctions principales du LCR est de fournir au SNC un environnement physicochimique remarquablement constant afin de maintenir sa fonction à son efficacité maximale.
Figure 5.3 Moulage en résine du système ventriculaire. A. Vue latérale. B. Vue postérieure. Source : Crossman AR, Neary D. Neuroanatomie. Trad. fr. coordonnée par J.-F. Vibert. Paris : Elsevier SAS (coll. Campus Illustré) ; 2004.
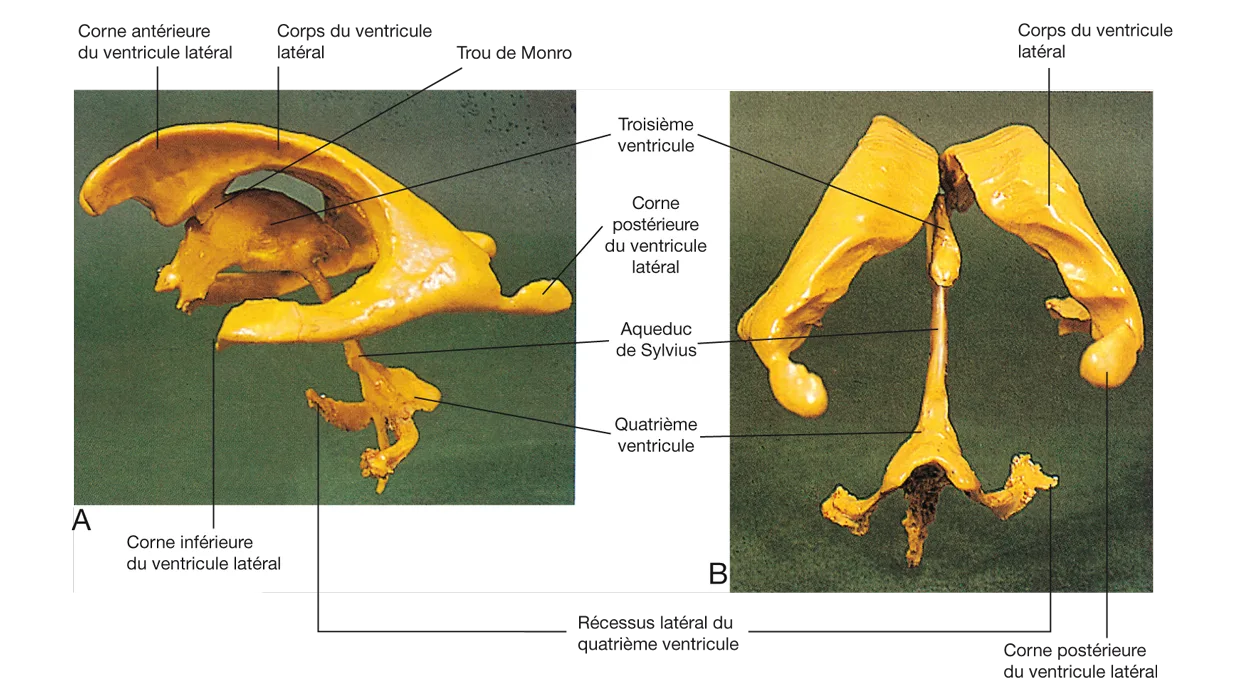
Figure 5.3 Moulage en résine du système ventriculaire
Composition du liquide céphalorachidien
C’est un liquide clair incolore de pH 7,32 environ. Son poids spécifique relatif est ≠ 1,005. Il contient de 3 à 5 lymphocytes par centimètre cube. Sa composition est différente de celle du plasma, bien qu’elle en soit voisine, comme le montre le tableau 5.1.
Tableau 5.1 Compositions comparées du plasma et du LCR.
| Empty table header | Plasma | LCR |
|---|---|---|
Na+ | 150 mmol/l | 147 mmol/l |
K+ | 4,6 mmol/l | 2,8 mmol/l |
Ca++ | A,8 mmol/l | 1,1 mmol/l |
Cl– | 115 mmol/l | 130 mmol/l |
HCO3– | 26 mmol/l | 22 mmol/l |
pH | 7,4 | 7,3 |
PCO2 | 45 mmHg | 50 mmHg |
Protéines | 8 g/100 ml | 0,02 g/100 ml |
Le liquide intraventriculaire est normalement dépourvu de cellules et de protéines ; celles-ci sont ajoutées au LCR dans l’espace sous-arachnoïdien par exsudation à partir des vaisseaux méningés, et proviennent probablement de cellules desquamées dans l’espace sous-arachnoïdien.
Le volume total de LCR chez l’homme est de 100 à 150 cm3. Lorsque le LCR est ponctionné ou est libre de s’écouler vers l’extérieur, sa vitesse de formation est de 20 cm3 à l’heure, soit à peu près 500 cm3 par 24 heures.
Production du liquide céphalorachidien
Le LCR est produit au niveau des plexus choroïdes pour la plus grande part, mais aussi au niveau des capillaires de l’espace sous-arachnoïdien, spinal et péri-encéphalique, et pour une faible part au niveau des vaisseaux intraparenchymateux. Il rejoint alors l’espace sous-arachnoïdien par les espaces périvasculaires de Virchow-Robin.
Plexus choroïdes
Le plexus choroïde est une différenciation du système pie-mère/capillaire. Il en existe partout, mais il y en a surtout au niveau des ventricules latéraux et de V4. Les plexus choroïdes sont responsables d’au moins 65 % du LCR produit dans les ventricules ainsi que de la clairance de solutés du LCR vers le sang, tels que d’anions étrangers, d’acides aminés et de prostaglandines.
L’épithélium choroïde est constitué d’une couche de cellules épithéliales à bordure en brosse disposées sur une membrane basale (figure 5.4). La jonction entre les cellules n’est pas parfaite et les capillaires sont fenêtrés. Cela fait qu’il existe des échanges libres entre le sang et le liquide interstitiel.
Figure 5.4 Plexus choroïdes. En haut : vue macroscopique (x10). En bas : vue microscopique (x400). Avec l’aimable autorisation du Dr N. Maurin, laboratoire d’histologie, faculté de médecine P. et M. Curie, site Saint-Antoine, UPMC, Paris.
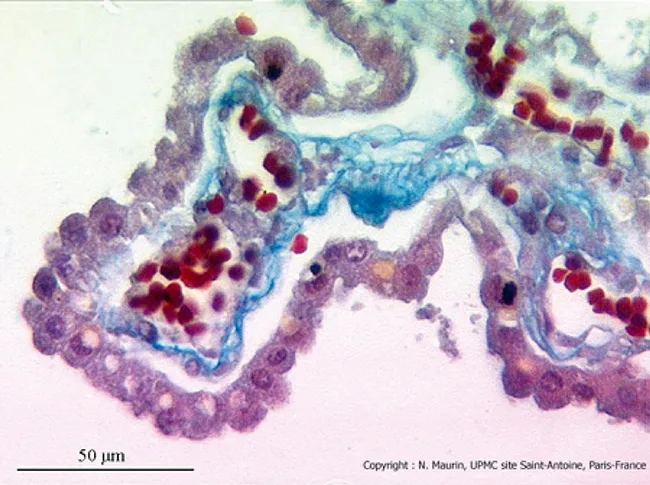
Figure 5.4
Mécanisme de la production
Le moteur principal de la sécrétion du LCR est le transfert actif du Na+ de l’espace interstitiel vers le ventricule. Cela se fait en deux étapes (figure 5.5).
Figure 5.5 Mécanisme de production du LCR dans la cellule choroïdale ou choroïde.
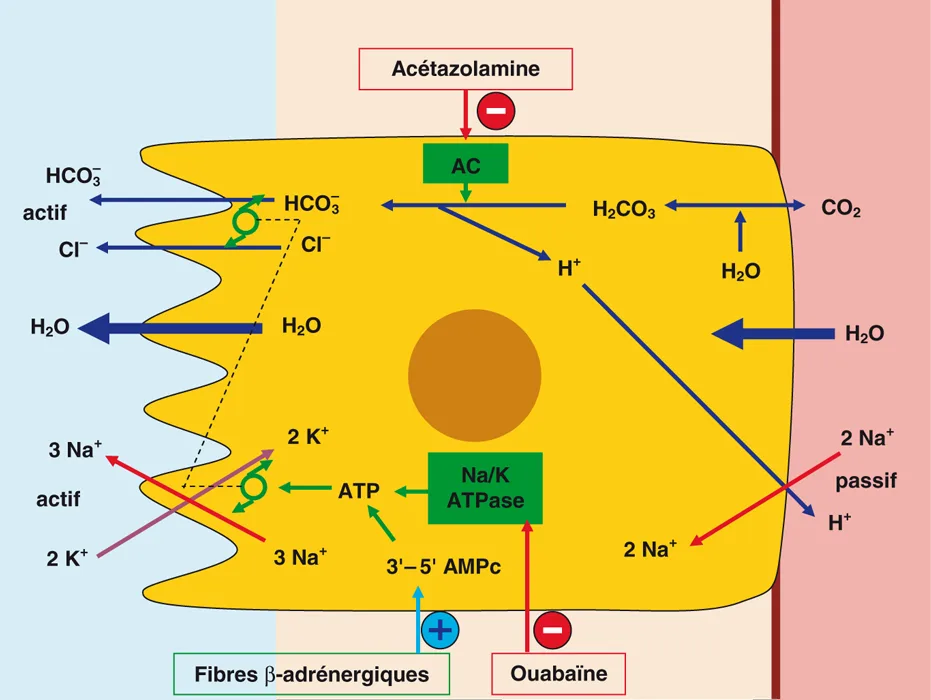
Figure 5.5 Mécanisme de production du LCR dans la cellule choroïdale ou choroïde
La première étape est passive, la seconde active. Le Na+ est échangé passivement à la base de la cellule suivant un gradient de potentiel. Puis il est rejeté dans le ventricule par une pompe Na/K qui fonctionne à l’ATP. Le débit de cette pompe à Na/K est limité par la vitesse d’entrée du Na+ au pôle basal de la cellule. De même, le CO2 entre dans la cellule, y est hydraté pour former de l’H2CO3 qui est lui-même scindé, sous l’action d’une anhydrase carbonique, en HCO3–, qui est rejeté du côté LCR, et H+, qui est échangé contre Na+.
La cellule choroïde rejette donc beaucoup d’ions et rend son pôle apical très hypertonique. C’est cela qui attire l’eau vers le ventricule, de façon passive, suivant un gradient osmotique. En résumé, les plexus choroïdes sécrètent un mélange de Na+, Cl– et d’anions comme HCO3–, ce qui entraîne l’eau dans les ventricules. Par ailleurs, ils réabsorbent du K+ du LCR vers le sang.
Cela explique pourquoi l’acétazolamine (Diamox®), qui est un inhibiteur de l’anhydrase carbonique, réduit la sécrétion de LCR. En effet, H2CO3 n’étant plus dissocié, les ions H+ diminuent, donc les ions Na+ rentrent moins et la pompe Na/K n’est plus alimentée et ne rejette donc plus de Na+, plus d’anions tampons et plus de bicarbonate, et donc l’eau ne suit plus. En effet, une pompe à anions est couplée à celle à Na/K.
Régulation de la production
La régulation de la sécrétion du LCR est encore mal comprise, mais on sait maintenant que les plexus choroïdes sont innervés par des fibres cholinergiques et adrénergiques et que la stimulation des fibres β-adrénergiques élève le taux de 3'-5' AMPc dans les plexus choroïdes, ce qui active la pompe à Na+ et donc augmente la sécrétion de LCR (voir figure 5.5). On notera que ni l’aldostérone ni l’ADH n’ont de rôle dans la régulation du LCR.
Régulation de la composition
Les plexus choroïdes sont aussi impliqués dans la régulation de la composition du LCR, puisqu’ils forment une barrière efficace contre le passage passif des anions dans les deux sens grâce à l’existence d’une pompe à anions apicale dont le fonctionnement est couplé à celui de la pompe à Na/K. Cette faible perméabilité aux anions est capitale pour la régulation du pH du LCR. En effet, les variations des taux de bicarbonates (H2CO3) dans le sang ne sont pas suivies immédiatement de variations dans le LCR, et protègent donc son pH au cours des acidoses et alcaloses métaboliques aiguës. Au contraire, le CO2 passant très facilement la barrière, les acidoses et alcaloses respiratoires retentissent rapidement sur le pH du LCR, ce qui, à l’état normal, contribue à stimuler les centres respiratoires dans le sens d’une compensation.
Circulation du liquide céphalorachidien
Le LCR, sécrété et régulé sur le plan métabolique par les plexus choroïdes, subit une circulation passive du lieu de production à son lieu d’élimination (figure 5.6) avec un débit de 20 cm3/h. Il est donc renouvelé trois fois par jour.
Figure 5.6 Le système ventriculaire cérébral et ses relations avec l’espace sous-arachnoïdien. La circulation du LCR est indiquée par des flèches. Source : Geraint Fuller, Mark R. Manford. Neurology: An Illustrated Colour Text. 3ed. Elsevier, 2010.
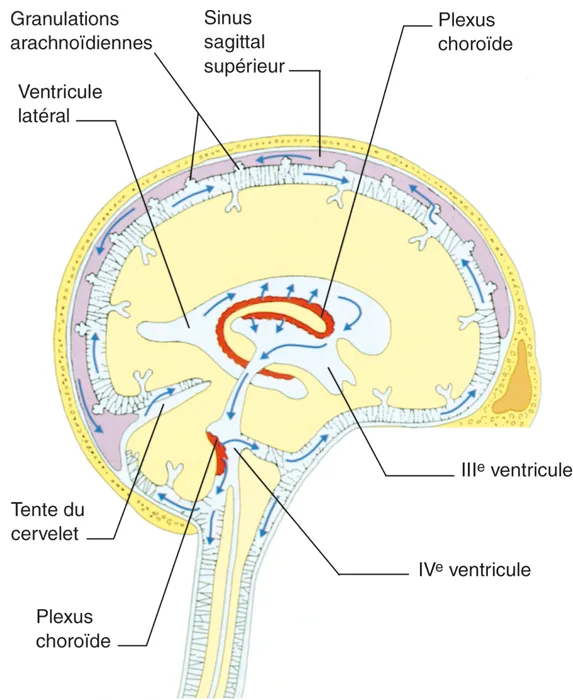
Figure 5.6 Le système ventriculaire cérébral et ses relations avec l’espace sous-arachnoïdien
Il est drainé par les villosités arachnoïdiennes (ou granulations de Pacchioni). Ce sont des hernies de l’arachnoïde dans les sinus veineux qui agissent comme des soupapes mues passivement par la différence de pression hydrostatique (0,5 à 5 cm H2O) ou osmotique (figure 5.7). Donc, le LCR passe dans les sinus duraux et dans les veines spinales et à un moindre degré dans la lymphe, le long des nerfs. Les quatre cinquièmes du LCR sont éliminés au niveau céphalique et un cinquième au niveau médullaire.
Figure 5.7 Coupe transversale du sinus sagittal supérieur montrant les villosités arachnoïdiennes. Source : Crossman AR, Neary D. Neuroanatomie. Trad. fr. coordonnée par J.-F. Vibert. Paris : Elsevier SAS (coll. Campus Illustré) ; 2004.
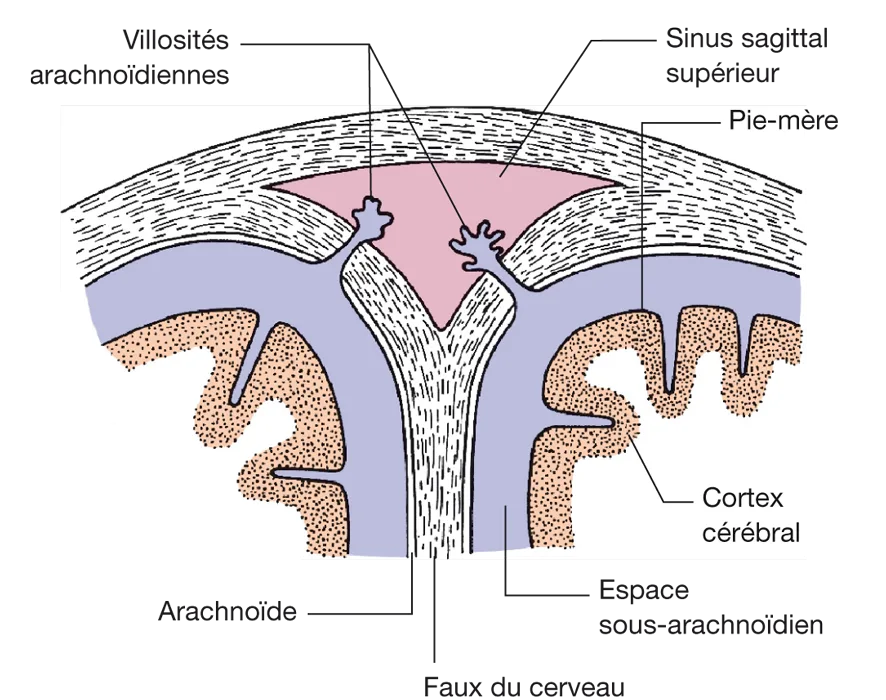
Figure 5.7
De même que les plexus choroïdes (l’appareil de production) sont surtout impliqués dans la régulation de la composition du LCR, les villosités arachnoïdiennes (l’appareil de drainage) régulent son volume et par là même sa pression (PLCR), qui dépend du rapport de la vitesse de sécrétion sur la vitesse de drainage.
Si, par une raison quelconque, la PLCR augmente, les villosités s’ouvrent afin de laisser échapper le LCR, ce qui ramène la PLCR à la normale. Cela évite que le tissu cérébral ne soit soumis à des pressions mécaniques, puisque le LCR a aussi un rôle mécanique : le cerveau pèse 1 500 g sur la table mais seulement 50 g dans le LCR. Celui-ci a un effet d’amortisseur liquide et de protection dans certaines positions (avec la tête en bas, le cerveau ne tire sur les vaisseaux et les nerfs qu’avec 50 g).
Pression du liquide céphalorachidien
La pression normale dépend de la vitesse de sécrétion et de la vitesse d’absorption. Chez l’homme couché en position latérale, elle varie entre 100 et 200 mmH2O. En position assise, la pression est de 200 mmH2O ; elle est toujours plus haute qu’en décubitus. L’augmentation de la pression veineuse qui découle d’actes tels que la toux, le cri ou les efforts de défécation fait augmenter la pression du LCR. La compression de la jugulaire a le même effet (signe de Queckenstedt-Stookey).
Rôle du liquide céphalorachidien
Le LCR sert de tampon et agit comme un réservoir régulateur du volume encéphalique : si le volume du parenchyme cérébral ou celui du sang intracérébral augmentent, le LCR est drainé ; au contraire, si le volume cérébral ou le volume sanguin cérébral diminuent, le LCR augmente. Enfin, le LCR sert dans une certaine mesure aux échanges nutritifs avec le tissu nerveux ; le cerveau réalise cependant ses échanges métaboliques, principalement avec le sang, via la barrière hématoencéphalique.
Barrières méningées
Il n’y a pas de substance contenue dans le LCR qui ne soit pas contenue dans le sang. Mais les échanges entre ces deux milieux sont régis par un système sélecteur appelé barrière hématoméningée.
Il existe trois barrières (figure 5.8) :
hématoméningée ;
hémato-encéphalique ;
méningo-encéphalique.
Figure 5.8 Les barrières méningées.
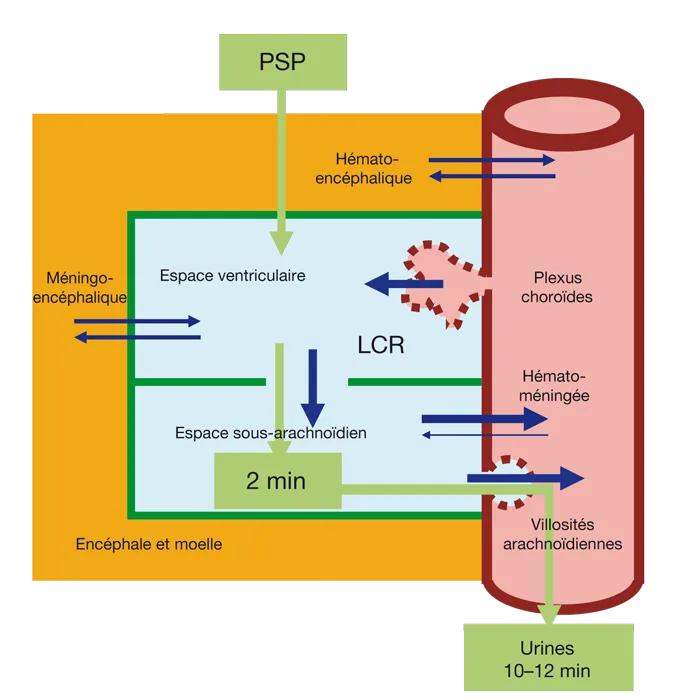
Figure 5.8 Les barrières méningées
Barrière hématoméningée
C’est la mieux connue. Sa perméabilité est faible dans le sens sang → LCR. Elle ne laisse passer que les petits ions. Les antibiotiques ne la franchissent pas, sauf les sulfamides (ce qui est important pour les méningites).
Sa perméabilité est grande dans le sens LCR → sang. Cela explique que les anesthésiques injectés en intrathécal soient rapidement éliminés.
Barrière hémato-encéphalique
Le concept de barrière hémato-encéphalique date de la fin du XIXe siècle. Un colorant injecté en intraveineux colorait tous les tissus, sauf le cerveau. Inversement, on constate en 1913 que le bleu Trypan injecté en intra-LCR colore le cerveau mais pas le reste. Avec l’apparition du microscope électronique, on constate vers 1950 que les cellules épithéliales des capillaires cérébraux sont réunies par des jonctions serrées et qu’ils sont entourés par des prolongements des astrocytes. Dans l’hypophyse, la glande pinéale et dans certaines régions de l’hypothalamus, il n’y a pas de barrière hémato-encéphalique ; cela permettrait à des hormones d’atteindre les neurones sécrétoires et de refermer les boucles de feedback neuroendocriniens.
Quel est le substrat anatomique de cette barrière ? La peroxydase du raifort en intraveineux ne passe pas dans le tissu cérébral, alors qu’elle diffuse très facilement dedans lorsqu’elle est injectée dans le LCR et pompée par les astrocytes. C’est donc bien la cellule endothéliale qui constitue l’élément anatomique de la barrière en passant par l’intermédiaire des cellules gliales astrocytaires (figure 5.9).
Figure 5.9 Composants de la barrière hémato-encéphalique.
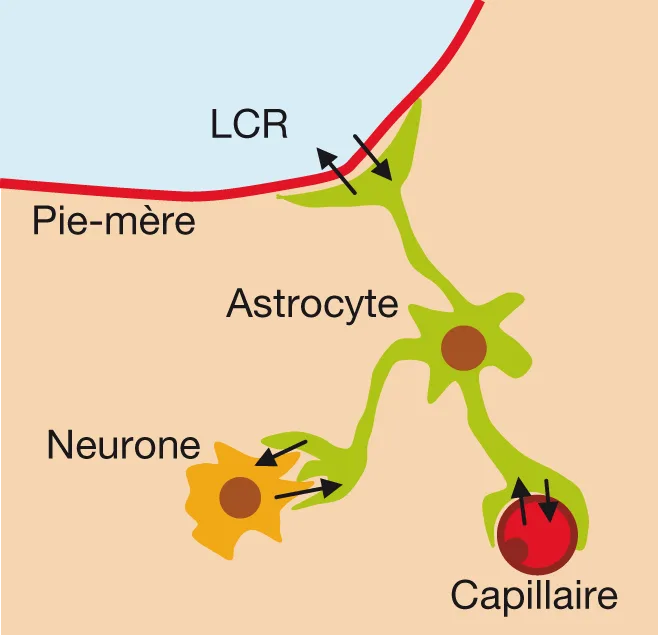
Figure 5.9
Les seules substances qui passent facilement la barrière sont les substances liposolubles (nicotine, éthanol et héroïne sont très liposolubles !). Certaines substances indispensables comme le glucose, non liposoluble, passent aussi. Elles sont soumises à un transport actif grâce à des transporteurs très spécifiques. Il existe des transports asymétriques : certains petits acides aminés peuvent passer la barrière endothéliale puis, une fois dans la cellule, ils sont transformés en composés incapables de ressortir de la cellule de l’autre côté : on parle de « barrière métabolique ». C’est le cas de la L-DOPA, précurseur de la dopamine, qui pénètre rapidement dans l’endothélium mais est transformée par des enzymes en une forme qui ne peut pas atteindre le cerveau.
On s’est interrogé sur la nature des capillaires impliqués dans la barrière hémato-encéphalique. Lorsque l’on greffe du tissu cérébral dans l’intestin, on constate que les capillaires intestinaux acquièrent les propriétés des capillaires cérébraux. À l’inverse, des capillaires cérébraux transplantés dans du muscle perdent leurs propriétés ; on a pu montrer par des greffes successives que ce sont des substances produites par les astrocytes qui sont responsables de ces propriétés.
L’injection de solution hyperosmotique de glucose dans la carotide augmente de façon rapide et importante la perméabilité de la barrière hémato-encéphalique, en affaiblissant les jonctions serrées de façon transitoire.
Cela est très important du point de vue pratique, car cela permet de faire pénétrer dans le tissu cérébral des substances non liposolubles en solution dans un solvant hypersucré injecté en intraveineux, et permet d’éviter des PL répétées.
Il est aussi possible d’utiliser la perméabilité sélective avec des substances qui peuvent traverser la barrière puis être métabolisées en une substance active incapable de retraverser et donc piégée au niveau des lésions à traiter.
Néanmoins, cette barrière hémato-encéphalique reste mal connue.
Barrière méningo-encéphalique
Cette barrière est encore plus mal connue. Elle est dans la paroi des ventricules de l’épendyme, du canal de l’épendyme et est constituée par la pie-mère. Elle est très perméable. Les astrocytes facilitent les échanges entre le LCR et le tissu nerveux. Cette barrière n’est pas traversée par les neurotransmetteurs. Elle assurerait une fonction d’épuration comme le fait la circulation lymphatique dans le reste de l’organisme. Elle expliquerait les accidents graves observés au décours d’injections intrathécales de pénicilline ou de lipiodol.
Exploration du liquide céphalorachidien
Le LCR s’explore en clinique par :
ventriculographie gazeuse ;
myélographie ;
les techniques d’imagerie informatisée (scanner, résonance magnétique nucléaire [RMN]) ;
et surtout par la PL.
Ponction lombaire
La PL permet de prélever du LCR en vue d’analyse, et de mesurer sa pression (normalement de 100-200 mmH2O en position couchée et de 300-400 mmH2O en position assise). Toux et cris augmentent la pression du LCR. La manœuvre de Queckenstedt-Stookey, qui consiste à comprimer les jugulaires internes, entraîne normalement une augmentation de la PLCR. Dans le cas contraire, cela signe la présence d’un obstacle.
Système glymphatique
Alors que le système lymphatique de drainage des différents organes du corps est connu depuis de nombreuses années, il a longtemps été pensé qu'il faisait défaut au SNC. Il a fallu attendre 2012 pour que le système glymphatique, qui assure cette fonction pour le cerveau, ne soit identifié par l'équipe de Maiken Nedergaard, retard provenant essentiellement de sa complexité et de la pauvreté des outils permettant de l'explorer.
Le système glymphatique assure le déplacement du LCR depuis les espaces sous-arachnoïdiens, le long des espaces péri-artériels (les espaces de Virchow-Robins pour les plus grosses artères), en interaction étroite avec le pied des astrocytes, où il se mêle alors au liquide interstitiel parenchymateux (figure 5.10). Il est ensuite drainé du parenchyme par les espaces périveineux vers le système lymphatique périphérique pour son évacuation finale. Les mouvements liquidiens sont produits par l'activité vasomotrice et par la respiration et sont maximaux durant le sommeil (ainsi d'ailleurs que durant l'anesthésie), notamment à ondes lentes. Certaines activités de réseaux neuronaux plus rapides, dans la bande gamma, pourraient renforcer l'activité glymphatique.
Le système glymphatique s'explore difficilement chez l'homme, principalement par étude de la dynamique de la clairance d'un produit de contraste administré en intrathécal, par mesure du volume des espaces périvasculaires en imagerie morphologique IRM ou par diffusion le long des espaces périvasculaires.
Le système glymphatique assure l'élimination du potassium, de nombreux métabolites et de déchets comme le lactate et les protéines, notamment l'amyloïde β et la protéine tau, ainsi qu'une variété d'agents de contraste (ce qui permet de le visualiser). Sa fonction principale est la « dépollution » de substances produites par l'activité cérébrale. Il semble ainsi participer aux fonctions restauratrices du sommeil. D'autres fonctions sont suggérées : régulation des activités cérébrales par le biais de l'homéostasie ionique, fonctions immunitaires du SNC.
Le système glymphatique semble se détériorer avec l'âge et, dans certaines pathologies, comme l'angiopathie amyloïde où les dépôts en plaques Aβ s'accumulent dans la paroi des vaisseaux, ou encore dans les pathologies des petits vaisseaux de maladies générales comme le diabète ou l'hypertension artérielle. Il est depuis peu impliqué dans la physiopathologie des pathologies neurodégénératives, principalement dans la maladie d'Alzheimer par défaut de drainage des plaques Aβ ou des agrégats de protéine tau. La mise en jeu du système glymphatique est aussi envisagée dans les AVC, les traumatismes crâniens et les tumeurs cérébrales.
Figure 5.10 Structure du système glymphatique. Le système glymphatique utilise les espaces périvasculaires (grossissement à gauche) autour des artères pour puiser le LCR dans l'espace extracellulaire. Les pieds astrocytaires recouvrent étroitement les espaces périvasculaires. Après l'entrée du LCR dans le parenchyme cérébral, le liquide se mélange au liquide interstitiel contenant des solutés interstitiels (protéines, ions, etc.) et est finalement dirigé vers les espaces périvasculaires veineux pour être évacué vers les vaisseaux lymphatiques méningés et le système veineux. Source : Beschorner N, Nedergaard M. Glymphatic system dysfunction in neurodegenerative diseases. Curr Opin Neurol 2024 ; 37 : 182-8.
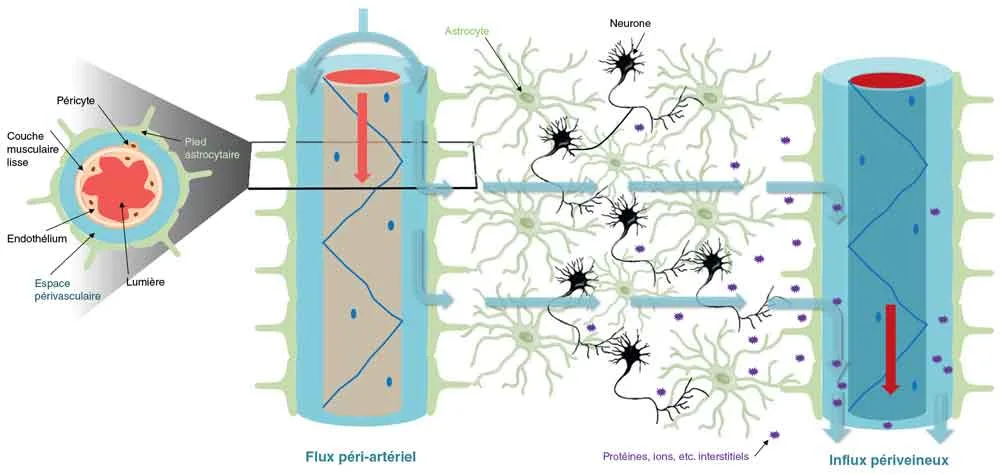
Fig 5.10
Tumeurs cérébrales et LCR
Lors d’une augmentation du volume provoquée par une tumeur cérébrale, le LCR diminue. Ensuite, on assiste à une compression des vaisseaux, à une compression des circonvolutions puis, progressivement, la pression augmente dans l’ensemble de la fosse antérieure (au-dessus de la tente du cervelet). L’augmentation de pression est évidemment transmise aux prolongations de l’espace sous-arachnoïdien qui entourent les nerfs optiques. Au niveau du nerf optique, la première perturbation fonctionnelle porte sur la circulation veineuse : le sang parvient par les artères à la papille, mais le retour veineux est gêné. Par voie de conséquence, les vaisseaux rétiniens sont engorgés et gonflés, et du liquide exsude au niveau des points de moindre résistance de la paroi vasculaire. Il en résulte l’aspect œdémateux de la papille à l’examen ophtalmoscopique.
Lorsque l’augmentation de pression est communiquée à la fosse postérieure, le cervelet vient obturer comme un bouchon le foramen magnum (ou trou occipital) et empêche le passage du LCR dans le canal médullaire où environ un cinquième du LCR est normalement réabsorbé. De plus, les foramens du quatrième ventricule sont déformés et partiellement bouchés. Un cercle vicieux est ainsi établi : comme le LCR ne peut pas s’échapper des ventricules où il est principalement produit et ne peut donc être réabsorbé, une hydrocéphalie apparaît. Cette dernière augmente encore la pression intracrânienne et enfonce en coin le cervelet dans le foramen magnum. On parle d’engagement bulbaire, et la mort résulte de l’ischémie bulbaire.
L’injection intraveineuse de 50 ml de solution de NaCl à 10 % permet de diminuer la PLCR pendant 2 heures environ car le LCR est alors réabsorbé vers le plasma. Cela peut suffire à faciliter une intervention chirurgicale, rendre la conscience, diminuer l’œdème papillaire. L’effet est transitoire car le Na et le Cl passent dans le LCR et rétablissent l’équilibre. Pour avoir un effet prolongé, il faut utiliser des substances qui passent mal dans le LCR, telle l’urée.
Hydrocéphalies
On entend par ce terme une accumulation pathologique de LCR, interne ou externe, suivant qu’elle intéresse le système ventriculaire ou l’espace sous-arachnoïdien. Théoriquement, l’hydrocéphalie peut être imputée à :
une hypersécrétion de LCR ; cette éventualité ne survient probablement jamais ;
une obstruction des voies d’écoulement du LCR ; celle-ci peut être : intraventriculaire, par blocage du trou de Monro, de l’aqueduc de Sylvius ou des foramens du quatrième ventricule. Le liquide contenu dans le ou les ventricules bloqués ne peut pas s’échapper et ne peut pas être absorbé localement. Son volume augmente progressivement en raison de la formation continue de liquide par les plexus choroïdes ; extraventriculaire :
par empêchement de la libre circulation de LCR dans l’espace sous-arachnoïdien, réduisant ainsi le nombre des villosités susceptibles d’absorber le LCR. Ainsi, un blocage du foramen magnum empêche le LCR de pénétrer dans l’espace sous-arachnoïdien et supprime de la sorte le cinquième de la surface de réabsorption ; de même, un blocage de l’orifice de la tente du cervelet empêche le LCR de la fosse postérieure dans l’espace sous-arachnoïdien supratensoriel où se produit la plus grande partie de la réabsorption ;
une inflammation des méninges peut bloquer la réabsorption au niveau des villosités ;
une thrombose des sinus veineux de la dure-mère empêche le drainage de l’espace sous-arachnoïdien vers le système veineux.
On parle d’hydrocéphalie communicante si de la phénolsulfophtaléine (PSP) injectée dans le ventricule latéral apparaît à la PL, 2 à 3 mm après, et de non-communication dans le cas contraire (voir figure 5.7).
Syndrome de Froin
Au cours d’une compression médullaire, la compression des veines spinales libère des globules et du plasma riche en protéines. L’hémoglobine donne une couleur jaune au LCR en se dégradant. On dit que le LCR est xantochromique.Cliniquement, les méningites chroniques, les tumeurs médullaires et les tumeurs méningées produisent un syndrome de Froin :
les protéines atteignent 0,5 à 4 g/100 ml, albumines et globulines étant présentes en proportions identiques ;
le LCR coagule spontanément du fait de la présence de fibrinogène ;
la xantochromie est de règle.
Par ailleurs, le nombre de cellules est normal (sauf en cas de lésion syphilitique). Lorsque l’espace sous-arachnoïdien médullaire est bloqué, la compression de la jugulaire au cou augmente la pression du LCR au-dessus du blocage alors qu’elle n’est pas modifiée au-dessous.
Biomarqueurs et maladie d’Alzheimer
Il existe trois biomarqueurs dans le LCR qui ont une sensibilité et une spécificité de plus de 80 % pour détecter la maladie d’Alzheimer :
la protéine Tau totale, reflet de la lyse neuronale, s’élève ;
la protéine Tau hyperphosphorylée (p-Tau), s’élève ;
le peptide β amyloïde (aβ1-42), s’abaisse.
Les sensibilités et les spécificités de ces trois marqueurs, et surtout du ratio p-Tau/aβ1-42, sont supérieures à 85 % pour discriminer la maladie d’Alzheimer du sujet normal, de la maladie de Parkinson, des troubles cognitifs reliés à l’alcool et du déclin cognitif des malades psychiatriques.
Vous venez de lire un chapitre de l'ouvrage Neurophysiologie.
Neurophysiologie © 2025 Elsevier Masson SAS. Tous droits réservés, y compris ceux relatifs à la fouille de textes et de données, à l'entraînement de l'intelligence artificielle et aux technologies similaires.
LES AUTEURS Cette 4e édition est le fruit du travail d’une équipe de 9 auteurs, coordonnée par Jean-François Vibert et Jean-Claude Willer.
Jean-François Vibert Jean-Claude Willer Emmanuelle Apartis Isabelle Arnulf Pauline Dodet Gilles Huberfeld Leonor Mazières Lionel Naccache Yulia Worbe
Neurophysiologie De la physiologie à l'exploration fonctionnelle - avec simulateur informatique ISBN 9782294786044 4e édition, 2025
