Quand intervenir en cas d’endométriose
31 mars 2016
Avant la procréation médicalement assistée ? Par Monique Remillieux
Découvrez le chapitre 6 de l’ouvrage Infertilité Prise en charge globale et thérapeutique sous la direction de René Frydman

Infertilité Prise en charge globale et thérapeutique
Quand intervenir en cas d'endométriose avant la PMA ?
Santulli, V. Gayet, L. Marcellin, M. Bourdon, P. Marzouk, D. de Ziegler, C. Chapron
Références auteurs
Pietro Santulli, MD, PhD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC), groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction, Paris, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital Cochin, laboratoire d’immunologie, EA 1833, Paris, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, Inserm, unité de recherche U1016, Institut Cochin, CNRS (UMR8104), Paris.
Vanessa Gayet, MD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC), groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction, Paris, France.
Louis Marcellin, MD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC), groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction, Paris.
Mathilde Bourdon, MD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC), groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction Paris.
Paul Marzouk, MD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC), groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction, Paris.
Dominique de Ziegler, MD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC), groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction, Paris.
Charles Chapron, MD, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, AP-HP, hôpital universitaire Paris Centre (HUPC) : groupe hospitalier universitaire Cochin, service de gynécologie obstétrique II et médecine de la reproduction, Paris ; laboratoire d’immunologie, EA 1833, Paris, Inserm, unité de recherche U1016, Institut Cochin, CNRS (UMR8104), Paris.
L’endométriose, pathologie inflammatoire dont la physiopathologie reste mal élucidée, est source de douleurs pelviennes et d’infertilité [1]. L’hétérogénéité est une des caractéristiques principales de l’endométriose. Cette hétérogénéité se manifeste tant sur le plan clinique qu’anatomique. Il existe trois phénotypes d’endométriose :
L’endométriose superficielle (SUP) constituée d’implants adhérents à la surface du péritoine ;
L’endométriome ovarien (OMA) qui est un kyste ovarien endométriosique à paroi épaisse et à contenu hématique ;
L’endométriose profonde (DIE), arbitrairement définie par une pénétration de la lésion d’au moins 5 mm sous le péritoine, ou encore par l’envahissement de la musculeuse de l’organe cible (figure 6.1).
Figure 6.1 Les différentes formes d’endométriose.
a. Endométriose superficielle.
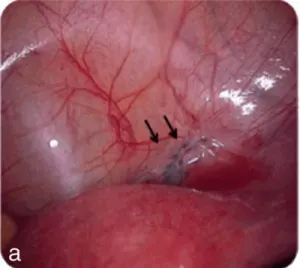
Endométriose superficielle
b. Endométriome.
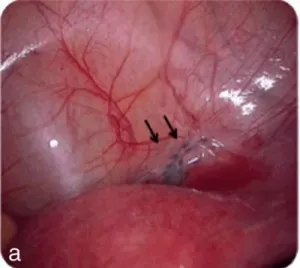
Endométriome
c. Endométriose profonde.
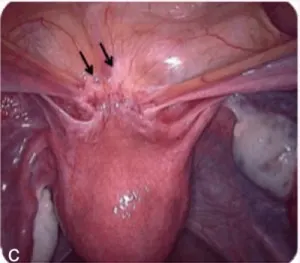
Endométriose profonde
L’endométriose a un impact sur la fertilité des patientes à trois niveaux [1] : la cavité abdominopelvienne ; l’ovaire ; l’utérus. Par souci de clarté, nous avons choisi de regrouper les différents mécanismes par lesquels l’endométriose affecte la reproduction, selon le territoire où ils s’exercent. L’avantage de cette classification est qu’elle permet de mieux comprendre les mécanismes d’action des différentes options thérapeutiques.
Impact de l’endométriose sur la fertilité
Inflammation de la cavité pelvienne et conception in vivo
Le phénomène de régurgitation menstruelle à l’origine de l’endométriose est responsable d’une importante réaction inflammatoire dans la cavité abdomino-pelvienne. Cette inflammation perturbe l’interaction entre spermatozoïde et ovocyte. Il en résulte une diminution des chances de conception spontanée ou in vivo. Les données de la littérature suggèrent que suite à une prise en charge chirurgicale, les possibilités de conception spontanée dans les 6 à 18 mois suivant l’intervention sont augmentées. Dans une étude rétrospective, Vercellini et al. ont rapporté que le taux de conceptions spontanées suite à une chirurgie était d’environ 50 %, indépendamment du stade de la maladie [2]. Ces résultats, en accord avec de nombreuses publications [2], sont corrélés à la qualité du geste chirurgical [3].
Endométriose ovarienne et réponse à la stimulation
La localisation ovarienne de l’endométriose se traduit par la formation d’endométriomes. Ceux-ci sont le résultat d’une invagination des lésions endométriosiques primaires qui, secondairement, se remplissent du sang accumulé au moment des menstruations au sein du tissu ectopique. Les endométriomes interfèrent avec le développement des follicules ovariens, non seulement en cas de fertilité spontanée [4] mais également dans un contexte de fécondation in vitro (FIV) où l’on note une diminution du nombre d’ovocytes recueillis lors de la stimulation ovarienne. Cependant, des études récentes retrouvent 43 % de conceptions spontanées à 6 mois dans une population de patientes porteuses d’endométriome ovarien [5]. L’impact de la présence d’un endométriome ovarien sur l’ovulation et la fertilité spontanée reste très controversé et devra, dans les années à venir, faire l’objet d’études spécifiques.
La conséquence principale de l’endométriose ovarienne réside dans une réponse sub-optimale voire nettement altérée à la stimulation ovarienne, notamment en présence d’endométriomes bilatéraux [6]. Cette diminution de la réponse ovarienne observée en cas d’endométriose est à différencier d’une réponse ovarienne insuffisante liée à l’âge. En effet, si la qualité ovocytaire est diminuée en cas de vieillissement ovarien dû à l’âge, elle ne semble pas être altérée en cas d’endométriose ovarienne [7].
La responsabilité de l’endométriose elle-même, de la présence d’endométriomes ou bien d’un antécédent de chirurgie pour endométriome, afin d’expliquer la mauvaise réponse ovarienne à la stimulation, est très débattue. Dans une étude récente, Streuli et al. ont démontré que la présence d’un antécédent de chirurgie pour endométriome ovarien était le facteur principal responsable d’une altération de la fonction ovarienne. Les auteurs ont montré que les taux d’AMH (anti-mullerian hormone) mesurés juste avant la chirurgie n’étaient pas altérés chez les patientes porteuses d’endométriomes, en comparaison à ceux observés chez des patientes du même âge indemnes de la pathologie. Les taux plasmatiques d’AMH étaient significativement diminués chez les patientes, porteuses ou non d’endométriomes, qui avaient un antécédent de chirurgie pour endométriome, en comparaison avec les patientes n’ayant jamais été opérées [8, 9].
Ces données supportent l’hypothèse selon laquelle ce serait la chirurgie du kyste endométriosique – et non l’endométriome en tant que tel – qui altérerait la réponse ovarienne. Ainsi, la décision d’opérer un endométriome peut être lourde de conséquences pour la fertilité des patientes. Dans la très grande majorité des cas, il convient de ne pas opérer les patientes lorsqu’une assistance médicale à la procréation (AMP) est envisagée.
Atteinte utérine et réceptivité endométriale
Des données récentes ont montré que l’endomètre eutopique était anormal en cas d’endométriose [10]. Ces altérations fonctionnelles rencontrées en cas d’endométriose semblent altérer la qualité de la réceptivité endométriale et expliquent ainsi les échecs de grossesse en AMP [11, 12]. Les principaux mécanismes en cause sont la résistance à la progestérone, l’inflammation et l’existence d’une stéroïdogenèse accrue [1, 13].
Il a été montré que les anomalies endométriales décrites dans l’endométriose régressaient suite à la suppression de la fonction ovarienne, via l’utilisation d’analogues agonistes de la GnRH (gonadotropin-releasing hormone analogue ou GnRH-a) [14] ou d’une pilule contraceptive [15].
Des essais cliniques ont montré que 3 à 6 mois de suppression ovarienne par utilisation de GnRH-a avant AMP amélioraient significativement les résultats [16]. En utilisant un traitement par GnRH-a, l’intensité de la réponse ovarienne à la stimulation n’était pas diminuée en comparaison à un groupe contrôle qui ne recevait pas de traitement avant AMP [16]. Il a récemment été suggéré qu’une normalisation de la réceptivité endométriale pouvait être obtenue dans l’endométriose en supprimant la fonction ovarienne à l’aide d’une pilule oestroprogestative, avec l’avantage majeur d’induire moins d’effets secondaires que les GnRH-a [17].
En pratique
La prise en charge de l’infertilité dans un contexte d’endométriose doit être globale en tenant compte, non seulement des douleurs qui peuvent être associées à l’infertilité, mais aussi du phénotype des lésions endométriosiques (SUP, OMA, DIE), éventuellement associé à une adénomyose utérine. Cette prise en charge optimale nécessite des centres pluridisciplinaires comprenant des chirurgiens, des praticiens experts en AMP, des endocrinologues, des radiologues… La patiente doit bénéficier d’un diagnostic de qualité avant d’avoir accès, au sein d’une même structure, à la totalité des options thérapeutiques possibles.
La chirurgie augmente les chances de conception spontanée dans les 6 à 18 mois. Ainsi, il est important de déterminer initialement si une conception spontanée est envisageable avant de planifier la prise en charge chirurgicale. De ce fait, il est nécessaire de s’assurer de la qualité du sperme et de la perméabilité tubaire. Il est également indispensable de déterminer à l’avance s’il paraît raisonnable pour la patiente de s’accorder un délai de 6 à 18 mois après la chirurgie dans le but d’obtenir une conception spontanée. Pour cela, il convient d’étudier la réserve ovarienne (FSH, oestradiol à J3, AMH et compte folliculaire) et de s’assurer que la patiente accepte ce délai. Les principes de la prise en charge chirurgicale se fondent sur le « radicalité de l’exérèse », reposant sur l’excision complète des lésions d’endométriose [18, 19].
Une telle stratégie ne pourra être envisagée qu’après avoir réalisé une cartographie préoperatoire de toutes les lésions d’endométriose à l’aide de l’imagerie (échographie pelvienne, IRM et échographie endorectale). Dans la pratique quotidienne, l’évaluation de l’intensité des symptômes douloureux permet d’orienter la réalisation des examens complémentaires radiologiques, notamment en cas d’endométriome ovarien. En effet, en présence d’endométriome ovarien, les douleurs pelviennes sévères sont significativement corrélées à la présence de lésions d’endométriose profonde associée. En cas d’endométriome douloureux, le clinicien doit réaliser un bilan approprié afin d’apprécier l’étendue de la maladie et de rechercher des lésions d’endométriose profonde [20].
Cette stratégie de prise en charge globale est non seulement efficace sur la symptomatologie douloureuse [18, 19, 21], mais aussi sur les possibilités de grossesse [22] tout en minimisant le risque de récidive [23–26]. Dans ce contexte, la chirurgie peut nécessiter la réalisation de résections étendues (coloproctectomie, cystectomie partielle, chirurgie urétérale), avec pour conséquence un risque de réelles complications (rétention chronique d’urine, fistule rectovaginale par exemple) [18, 19]. La chirurgie, notamment pour les patientes présentant des lésions de DIE, doit être réalisée par des équipes entraînées offrant un plateau chirurgical multidisciplinaire (chirurgies gynécologique, intestinale et urologique).
Si une prise en charge chirurgicale est finalement retenue, il n’y a pas d’intérêt à proposer des procédures intermédiaires comme les stimulations–inséminations intra-utérines, qui n’offrent aucun bénéfice démontré dans ce contexte [27]. Au bout du délai préétabli de 6 à 18 mois et en l’absence de conception spontanée, une AMP doit être proposée.
Lorsque l’âge de la patiente et/ou une faible réserve ovarienne excluent la possibilité d’attendre 6 à 18 mois après la chirurgie, ou encore lorsque le sperme et/ou le statut tubaire sont incompatibles avec une conception spontanée, une AMP doit être entreprise en première intention. Dans ces cas, une suppression de la fonction ovarienne est recommandée avant AMP, que ce soit par des GnRH-a pendant 3 à 6 mois ou par pilule oestroprogestative pendant 6 à 9 semaines.
La chirurgie n’est pas recommandée avant l’AMP, puisqu’elle n’améliore pas les chances de succès. Cette nouvelle règle – « pas de chirurgie avant FIV » – comporte tout de même certaines exceptions, il convient d’envisager une chirurgie avant AMP en cas de :
Douleurs pelviennes invalidantes ;
Hydrosalpinx ;
Doute sur la bénignité de la lésion ovarienne.
Le cas particulier de l’endométriome
L’endométriome est la « lésion clé » en matière de prise en charge de l’endométriose. En effet, il a été démontré que si la chirurgie permet d’augmenter les chances de grossesse spontanée, elle estaussi associée à une altération de la réserve ovarienne [9, 28]. Dans un contexte d’endométriose, la diminution de la réserve ovarienne a un pronostic de fertilité nettement moins bon comparé à celui d’une diminution de la réserve ovarienned’autre origine [29]. Puisqu’il n’existe aucune évidence à l’heure actuelle quant à la supériorité de la chirurgie par rapport à l’AMP en termes de taux de grossesses, en présence d’endométriome, la stratégie thérapeutique dépend de la balance bénéfices/risques.
En cas d’endométriome bilatéral chez une patiente infertile, le risque majeur d’altération de la réserve ovarienne [6] doit faire orienter la patiente vers l’AMP de première intention.
En cas de récidive d’endométriome après kystectomie, le risque de diminution de la réserve ovarienne en cas de chirurgie itérative est considérablement augmenté [8]. Dans ces situations, il est préférable d’orienter la patiente vers une AMP [30, 31].
Dans tous les cas où une AMP a été décidée dans un contexte d’endométriome ovarien, une antibioprophylaxie doit encadrer la ponction d’ovocytes afin de diminuer le risque de surinfection.
Selon certaines équipes, la taille importante de l’endométriome peut motiver les praticiens à réaliser une kystectomie avant prise en charge en AMP afin de diminuer les risques liés à l’AMP à savoir : infection d’endométriome, rupture kystique, difficulté d’accès aux follicules ou encore aggravation d’une éventuelle symptomatologie douloureuse. Cependant, ces risques demeurent théoriques et n’imposent pas une exérèse systématique des endométriomes avant AMP [32]. En conséquence, se pose l’éternel problème de la taille limite de l’endométriome au-delà de laquelle une prise en charge chirurgicale est indispensable avant AMP. De nos jours, les données de la littérature sont insuffisantes pour établir un seuil de taille précis. Nous pensons qu’en dessous de 6 à 8 cm, aucun geste n’est nécessaire avant une prise en charge en AMP. En cas d’endométriome très volumineux, un drainage sous échoguidage 2 à 4 semaines avant la procédure d’AMP peut être envisagé et semblerait améliorer les résultats de la stimulation [33].
Cependant, lorsque le risque de diminution de la réserve ovarienne est important et que la chirurgie ne peut pas être évitée, il paraît utile de mettre en place une stratégie de préservation de la fertilité en préopératoire via une cryopréservation d’ovocytes ou d’embryons [34].
Le cas particulier de l’adénomyose
L’adénomyose est définie par la présence de glandes endométriales et de stroma cytogène, en position ectopique, à l’intérieur du myomètre. Dans une étude prospective, Naftalin et al. ont mis en évidence, après analyse multivariée, l’existence d’une association significative entre l’adénomyose et l’âge, la gestité ainsi que l’existence d’une endométriose pelvienne [35]. L’adénomyose est responsable d’une diminution de 30 % des chances de grossesse en AMP ainsi qu’une augmentation du taux de fausses couches spontanées [36]. L’impact de l’adénomyose semble être encore plus inquiétant en cas de chirurgie d’une endométriose digestive. En effet, une revue de la littérature évaluant les taux de grossesses après chirurgie de l’endométriose digestive met en évidence une réduction de 68 % des chances de grossesse en cas d’adénomyose [37]. Cependant, ces données sont controversées puisqu’une étude prospective récente a montré que l’adénomyose asymptomatique n’affectait pas les taux d’implantation et de grossesse en FIV [38]. Compte tenu de la difficulté de la chirurgie conservatrice en matière d’adénomyose, le recours à l’AMP devrait, dans ce contexte, être privilégié. Les modalités de l’AMP en cas d’adénomyose sont peu étudiées. Les séries préliminaires plaident clairement pour un effet bénéfique des analogues de la GnRH, prescrits pour une durée de 2 à 6 mois, sur les chances de grossesse [39, 40].
Conclusion
La prise en charge de l’endométriose dans un contexte d’infertilité exige une réflexion globale sur les chances de conception spontanée, mais aussi de faire le bilan exact de l’étendue des lésions endométriosiques ainsi que l’évaluation de leur impact clinique.
L’observation de cette stratégie permettrait d’éviter que le traitement proposé à la patiente endométriosique infertile ne dépende que de l’avis du premier médecin rencontré, comme c’est encore trop souvent le cas.
Ceci est le chapitre 6 de l’ouvrage Infertilité Prise en charge globale et thérapeutique sous la direction de René Frydman
Références
En savoir plus
de Ziegler D, Borghese B, Chapron C. Endometriosis and infertility : pathophysiology and management. Lancet 2010 ; 376 : 730–8.
Vercellini P, Somigliana E, Vigano P, et al. Surgery for endometriosis-associated infertility : a pragmatic approach. Hum Reprod 2009 ; 24 : 254–69.
Stepniewska A, Pomini P, Bruni F, et al. Laparoscopic treatment of bowel endometriosis in infertile women. Hum Reprod 2009 ; 24 : 1619–25.
Benaglia L, Somigliana E, Vercellini P, et al. Endometriotic ovarian cysts negatively affect the rate of spontaneous ovulation. Hum Reprod 2009 ; 24 : 2183–6.
Leone Roberti Maggiore U, Scala C, Venturini PL, et al. Endometriotic ovarian cysts do not negatively affect the rate of spontaneous ovulation. Hum Reprod 2015 ; 30 : 299–307.
Busacca M, Riparini J, Somigliana E, et al. Postsurgical ovarian failure after laparoscopic excision of bilateral endometriomas. Am J Obstet Gynecol 2006 ; 195 : 421–5.
Ferraretti AP, La Marca A, Fauser BC, et al. ESHRE consensus on the definition of ‘poor response’ to ovarian stimulation for in vitro fertilization : the Bologna criteria. Hum Reprod 2011 ; 26 : 1616–24.
Streuli I, de Ziegler D, Gayet V, et al. In women with endometriosis anti-Mullerian hormone levels are decreased only in those with previous endometrioma surgery. Hum Reprod 2012 ; 27 : 3294–303.
Raffi F, Metwally M, Amer S. The impact of excision of ovarian endometrioma on ovarian reserve : a systematic review and meta-analysis. J Clin Endocrinol Metab 2012 ; 97 : 3146–54.
Wang G, Tokushige N, Fraser IS. Nerve fibers and menstrual cycle in peritoneal endometriosis. Fertil Steril 2011 ; 95 : 2772–4.
Giudice LC, Telles TL, Lobo S, Kao L. The molecular basis for implantation failure in endometriosis : on the road to discovery. Ann N Y Acad Sci 2002 ; 955 : 252–64 discussion 93-5, 396-406.
Pabona JM, Simmen FA, Nikiforov MA, et al. Kruppel- like factor 9 and progesterone receptor coregulation of decidualizing endometrial stromal cells : implications for the pathogenesis of endometriosis. J Clin Endocrinol Metab 2012 ; 97 : E376–92.
Aghajanova L, Velarde MC, Giudice LC. Altered gene expression profiling in endometrium : evidence for progesterone resistance. Semin Reprod Med 2010 ; 28 : 51–8.
Kamada Y, Nakatsuka M, Asagiri K, et al. GnRH agonist-suppressed expression of nitric oxide synthases and generation of peroxynitrite in adenomyosis. Hum Reprod 2000 ; 15 : 2512–9.
Choi YS, Cho S, Lim KJ, et al. Effects of LNG-IUS on nerve growth factor and its receptors expression in patients with adenomyosis. Growth Factors 2010 ; 28 : 452–60.
Surrey ES, Silverberg KM, Surrey MW, Schoolcraft WB. Effect of prolonged gonadotropin-releasing hormone agonist therapy on the outcome of in vitro fertilization-embryo transfer in patients with endometriosis. Fertil Steril 2002 ; 78 : 699–704.
de Ziegler D, Gayet V, Aubriot FX, et al. Use of oral contraceptives in women with endometriosis before assisted reproduction treatment improves outcomes. Fertil Steril 2010 ; 94 : 2796–9.
Dousset B, Leconte M, Borghese B, et al. Complete surgery for low rectal endometriosis : long-term results of a 100-case prospective study. Ann Surg 2010 ; 251 : 887–95.
Meuleman C, Tomassetti C, D’Hoore A, et al. Surgical treatment of deeply infiltrating endometriosis with colorectal involvement. Hum Reprod Update 2011 ; 17 : 311–26.
Chapron C, Santulli P, de Ziegler D, et al. Ovarian endometrioma : severe pelvic pain is associated with deeply infiltrating endometriosis. Hum Reprod 2012 ; 27 : 702–11.
Jacobson TZ, Duffy JM, Barlow D, et al. Laparoscopic surgery for pelvic pain associated with endometriosis. Cochrane Database Syst Rev 2009 ; 4.
Jacobson TZ, Duffy JM, Barlow D, et al. Laparoscopic surgery for subfertility associated with endometriosis. Cochrane Database Syst Rev 2010 ; 1.
Borghese B, Santulli P, Streuli I, et al. Recurrence of pain after surgery for deeply infiltrating endometriosis : How does it happen ? How to manage ? J Gynecol Obstet Biol Reprod 2014 ; 43 : 12–8.
Garry R, Clayton R, Hawe J. The effect of endometriosis and its radical laparoscopic excision on quality of life indicators. BJOG 2000 ; 107 : 44–54.
Guo SW. Recurrence of endometriosis and its control. Hum Reprod Update 2009 ; 15 : 441–61.
Vercellini P, Crosignani PG, Abbiati A, et al. The effect of surgery for symptomatic endometriosis : the other side of the story. Hum Reprod Update 2009 ; 15 : 177–88.
Gandhi AR, Carvalho LF, Nutter B, Falcone T. Determining the fertility benefit of controlled ovarian hyperstimulation with intrauterine insemination after operative laparoscopy in patients with endometriosis. J Minim Invasive Gynecol 2014 ; 21 : 101–8.
Roman H, Quibel S, Auber M, et al. Recurrences and fertility after endometrioma ablation in women with and without colorectal endometriosis : a prospective cohort study. Hum Reprod 2015 ; 30 : 558–68.
Roustan A, Perrin J, Debals-Gonthier M, et al. Surgical diminished ovarian reserve after endometrioma cystectomy versus idiopathic DOR : comparison of in vitro fertilization outcome. Hum Reprod 2015 ; 30 : 840–7.
Ferrero S, Scala C, Racca A, et al. Second surgery for recurrent unilateral endometriomas and impact on ovarian reserve : a case-control study. Fertil Steril 2015 ; 103 : 1236–43.
Muzii L, Achilli C, Lecce F, et al. Second surgery for recurrent endometriomas is more harmful to healthy ovarian tissue and ovarian reserve than first surgery. Fertil Steril 2015 ; 103 : 738–43.
Somigliana E, Benaglia L, Paffoni A, et al. Risks of conservative management in women with ovarian endometriomas undergoing IVF. Hum Reprod Update 2015 ; 21 : 486–99.
Guo YH, Lu N, Zhang Y, et al. Comparative study on the pregnancy outcomes of in vitro fertilization-embryo transfer between long-acting gonadotropin- releasing hormone agonist combined with transvaginal ultrasound-guided cyst aspiration and long-acting gonadotropin-releasing hormone agonist alone. Contemp Clin Trials 2012 ; 33 : 1206–10.
Somigliana E, Vigano P, Filippi F, et al. Fertility preservationin women with endometriosis : for all, for some, for none ? Hum Reprod 2015 ; 30 : 1280–6.
Naftalin J, Hoo W, Pateman K, et al. How common is adenomyosis ? A prospective study of prevalence using transvaginal ultrasound in a gynaecology clinic. Hum Reprod 2012 ; 27 : 3432–9.
Vercellini P, Consonni D, Dridi D, et al. Uterine adenomyosis and in vitro fertilization outcome : a systematic review and meta-analysis. Hum Reprod 2014 ; 29 : 964–77.
Vercellini P, Consonni D, Barbara G, et al. Adenomyosis and reproductive performance after surgery for rectovaginal and colorectal endometriosis : a systematic review and meta-analysis. Reprod Biomed Online 2014 ; 28 : 704–13.
Benaglia L, Cardellicchio L, Leonardi M, et al. Asymptomatic adenomyosis and embryo implantation in IVF cycles. Reprod Biomed Online 2014 ; 29 : 606–11.
Tremellen K, Russell P. Adenomyosis is a potential cause of recurrent implantation failure during IVF treatment. Aust N Z J Obstet Gynaecol 2011 ; 51 : 280–3.
Niu Z, Chen Q, Sun Y, Feng Y. Long-term pituitary downregulation before frozen embryo transfer could improve pregnancy outcomes in women with adenomyosis. Gynecolo Endocrinol 2013 ; 29 : 1026–30.