Hémorragie du post-partum
France | 28 juillet 2018
Par Monique Remillieux
mortalité maternelle par hémorragie obstétricale a significativement diminué ces dernières années (RMM 1,2/100 000 naissances vivantes en 2010-2012 vs 2,2/100 000 naissances vivantes en 2001-2003. L’HPP complique 5 % des accouchements et est considérée comme sévère dans 2 % des accouchements.
Diagnostic
L’HPP est définie par des pertes sanguines ≥ 500 mL après l’accouchement, quelle qu’en soit la voie, et est considérée comme sévère à partir d’un saignement ≥ 1 000 mL. Le diagnostic d’HPP peut être difficile car les pertes sanguines sont difficiles à quantifier et très souvent sous-estimées. Depuis 2014, la mise en place d’un sac de recueil est recommandée en cas de saignements supérieurs à la normale. Par ailleurs, les pertes sanguines ne sont, parfois, pas extériorisées (notamment en cas d’hémopéritoine ou en présence d’un méchage utérin). La tolérance maternelle hémodynamique peut être excellente de manière prolongée et faussement rassurante. Ainsi, devant toute suspicion d’HPP, les premières étapes de la prise en charge doivent être débutées sans retard, ce qui, souvent, permettra d’éviter l’évolution vers une forme sévère et le recours à des thérapeutiques invasives.
Prise en charge
La prise en charge optimale des HPP est multidisciplinaire, réalisée de manière conjointe et simultanée par l’équipe obstétricale et celle d’anesthésie-réanimation, dont chaque intervenant doit être appelé dès le diagnostic. La rapidité de la prise en charge est un facteur majeur de son efficacité. Elle est guidée par des algorithmes de prise en charge établis par les RPC publiées en décembre 2014 et qui distinguent, d’une part, l’HPP après un accouchement voie basse ( fig. 42.1 ) et l’HPP dans un contexte de césarienne ( fig 42.2 ) (cette distinction concerne principalement la prise en charge obstétricale) et, d’autre part, la prise en charge initiale de l’HPP et la prise en charge de l’HPP sévère. Il est également recommandé de colliger toutes les étapes de la prise en charge de l’HPP, ainsi que les constantes hémodynamiques et les résultats biologiques sur une feuille de surveillance spécifiquement dédiée à l’HPP et adaptée au fonctionnement de la maternité, sur laquelle figureront l’heure de l’accouchement et celle du diagnostic d’HPP.
Figure 42.1. Prise en charge de l’HPP après un accouchement par voie basse. (Cliquez pour agrandir)
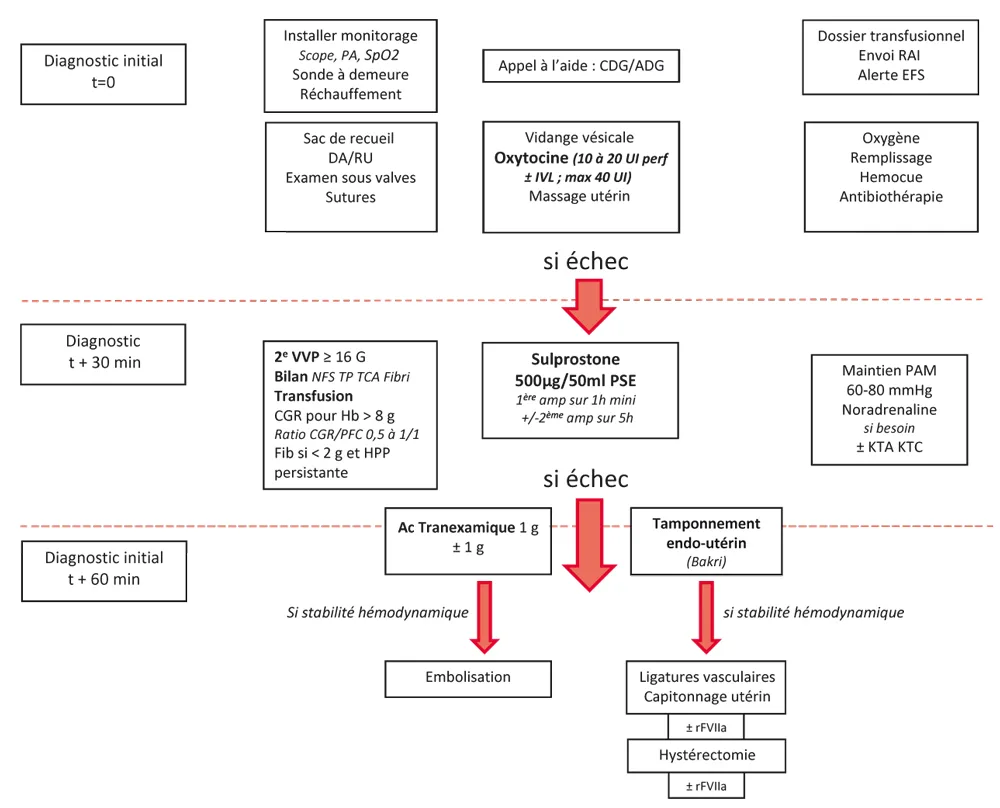
Figure 42.1
Figure 42.2. Prise en charge de l’HPP après un accouchement par césarienne.
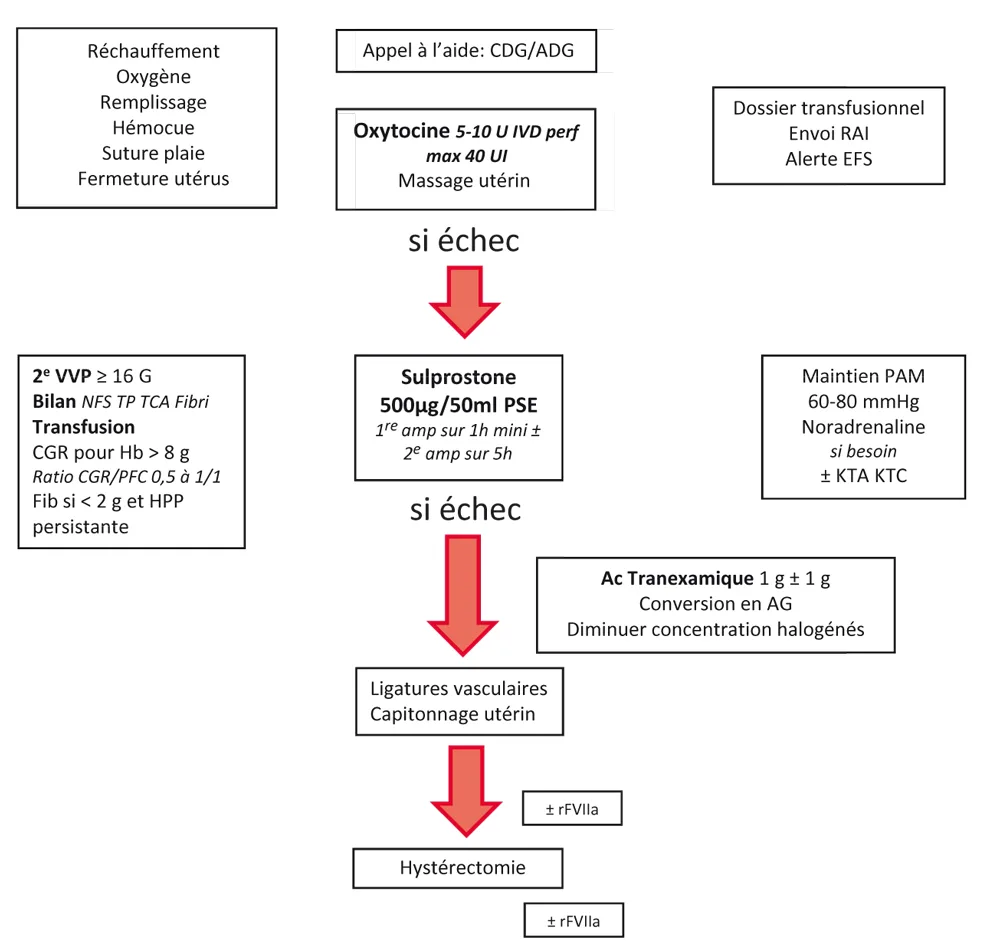
Figure 42.2
Selon les RPC de 2014, après un accouchement voie basse, la prise en charge obstétricale consiste à réaliser, après un sondage vésical évacuateur, une délivrance artificielle ou directement une révision utérine si l’HPP survient après la délivrance. L’intégrité de la filière génitale doit également être examinée sous valves et les éventuelles plaies suturées. Simultanément, il est recommandé d’administrer 5 à 10 UI d’oxytocine par voie IVL ou en IM puis une perfusion continue de 5 à 10 UI/h pendant 2 heures, sans dépasser une dose cumulée de 40 UI. Parallèlement, l’équipe d’anesthésie-réanimation doit mettre en place un monitorage non invasif (scope, SpO2, PA/5 minutes), une oxygénothérapie, sécuriser la voie veineuse et administrer un remplissage vasculaire par cristalloïdes, tout en luttant contre l’hypothermie. Une analgésie efficace doit être procurée pour la réalisation des gestes endo-utérins, en privilégiant les techniques périmédullaires, sauf en cas d’HPP d’emblée sévère et/ou de mauvaise tolérance hémodynamique, cas dans lesquels une anesthésie générale est alors préconisée. La pose d’une seconde voie veineuse à ce stade est l’occasion de réaliser une mesure de l’hémoglobinémie rapide (HémoCue®) et des prélèvements sanguins initiaux. La vérification d’une carte de groupe valide et de RAI de moins de 3 jours fait également partie de la prise en charge initiale. Cette prise en charge multidisciplinaire doit être efficace en moins de 30 minutes. Au-delà, des moyens supplémentaires doivent être mis en place, constituant la prise en charge de l’HPP qui s’aggrave ou HPP sévère d’emblée. En cas de césarienne, les principes de la prise en charge d’anesthésie-réanimation sont comparables ; la prise en charge obstétricale consiste principalement à réaliser une hémostase chirurgicale rapide à ce stade.
Prise en charge de l’HPP persistant malgré les mesures initiales ou sévère d’emblée
Dans le contexte d’HPP persistante malgré la prise en charge initiale et après un accouchement voie basse, l’administration de sulprostone dans les 30 minutes suivant le diagnostic d’HPP (ou avant en cas d’hémorragie sévère d’emblée) est recommandée en cas d’atonie utérine résistante aux oxytociques. La posologie initiale est en général de 500 μ en 1 heure IVSE. Le débit peut être secondairement abaissé à 100 μ /h lorsque l’hémorragie est contrôlée. Si le saignement persiste malgré la perfusion de sulprostone, la pose d’un tamponnement intra-utérin peut être proposée avant d’envisager le recours à une embolisation ou à une prise en charge chirurgicale. Par ailleurs, en cas de discordance entre la quantité de pertes sanguines estimée et la tolérance hémodynamique, il est recommandé de réaliser une échographie abdominale à la recherche d’un hémopéritoine. En cas d’échec de l’administration de sulprostone et du tamponnement intra-utérin, un traitement invasif doit être envisagé, il peut s’agir d’une embolisation des artères utérines en cas de stabilité hémodynamique de la patiente, dans le cas contraire un geste chirurgical de type ligature des artères utérines ou en plicature utérine type B-Lynch doit être réalisé. Ces deux techniques chirurgicales peuvent être associées. À ce stade de la prise en charge chirurgicale, une anesthésie générale doit être envisagée, dont le protocole doit prendre en compte l’état hémodynamique de la patiente. L’embolisation des artères utérines, nécessitant un transfert vers un plateau technique spécifi que, ne peut être envisagée qu’en cas de stabilité hémodynamique de la patiente. La décision d’embolisation doit donc être prise après discussion pluridisciplinaire. Enfin, en l’absence de réponse au traitement chirurgical conservateur ou en première intention en cas d’HPP massive et d’état hémodynamique précaire, une hystérectomie d’hémostase doit être envisagée. Rappelons la nécessité de disposer d’un référent obstétricien joignable en permanence dans chaque maternité pour réaliser des gestes chirurgicaux d’hémostase (ligatures vasculaires, capitonnage utérin et/ou hystérectomie) si l’obstétricien sur place n’en a pas la compétence. Lorsque l’HPP survient en cours de césarienne après échec de la sulprostone, l’embolisation artérielle ne doit pas être proposée et le traitement chirurgical conservateur doit être envisagé. En cas d’HPP survenant après césarienne et échec de sulprostone, il est préférable de s’orienter vers l’embolisation ou la pose d’un tamponnement intra-utérin en l’absence de retentissement hémodynamique trop sévère de l’HPP.
Prise en charge anesthésique de l’hémorragie sévère ou résistante au traitement médical et ses composantes
Stratégie transfusionnelle
La stratégie transfusionnelle est actuellement plus agressive. L’initiation de la transfusion en CGR doit être principalement envisagée sur des signes cliniques de gravité de l’HPP (mauvaise tolérance hémodynamique, saignement abondant et rapide). Selon les recommandations de 2014, la priorité est donnée à la transfusion en CGR, avec pour objectif de maintenir un Hb > 8 g/dL tant que l’hémorragie persiste. La transfusion de PFC doit également être débutée rapidement avec un ratio CGR/PFC compris entre 1/2 et 1 :1 :1, en particulier au-delà de 3 CGR. L’apport de PFC pourra être commencé sans attendre le résultat du bilan d’hémostase si la gravité de la situation paraît l’exiger. L’apport de plaquettes est également à anticiper compte tenu des délais d’acheminement. Classiquement, la transfusion est recommandée en cas de thrombopénie inférieure à 50 000/mm3 . Actuellement l’administration de fibrinogène concentré présente pour intérêt principal de pouvoir apporter du fibrinogène plus rapidement et avec des volumes de perfusion plus petits que le PFC. En cas de coagulopathie clinique et/ou biologique avérée et d’un délai prévisible de l’administration de PFC, du fibrinogène concentré peut être administré. L’efficacité transfusionnelle et la sévérité de l’HPP doivent être surveillées par des mesures de l’hémoglobine rapide (HémoCue®) et des bilans sanguins répétés (NFS plaquettes, TP TCA, fibrinogénémie) jusqu’à ce que l’hémorragie soit contrôlée. Une fibrinogénémie < 2 g/L est un excellent marqueur de sévérité de l’HPP. Le remplissage vasculaire doit être réalisé en cas de mauvaise tolérance hémodynamique, mais la priorité devra être donnée à la transfusion dans ce cas pour éviter une hémodilution aggravant la coagulopathie. De même, il faudra envisager un recours à la noradrénaline en cas de choc hémorragique, dont l’administration peut être débutée sur une VVP, puis idéalement sur un cathéter central. Le monitorage devra par ailleurs être complété par une mesure invasive de la PA avec mise en place d’un cathéter artériel.
Autres traitements
Suite à la publication de l’essai WOMAN, postérieure à celle des RPC de 2014, on peut recommander d’administrer de l’acide tranexamique (1 g en 20 minutes, répété une fois en cas d’échec au bout de 30 minutes) précocement dans la prise en charge en cas de plaie de la filière génitale et de manière concomitante à l’utilisation de la sulprostone dans les autres contextes en particulier en cas d’atonie utérine. Cependant l’administration d’acide tranexamique devra être évitée en cas d’insuffisance rénale ou de prééclampsie sous-jacente. L’administration de facteur VII activé (rFVIIa) est à envisager dans les cas d’hémorragies sévères non contrôlées, après échec des thérapeutiques conventionnelles chirurgicales conservatrices et si l’objectif est d’éviter l’hystérectomie (par exemple chez la parturiente jeune primipare) ou après hystérectomie. La dose recommandée est de 90 μ /kg en une administration unique, renouvelable une fois en cas d’échec. Dans le même temps, pour optimiser l’efficacité du rFVIIa, l’acidose, l’hypothermie, l’hypofibrinogénémie et la thrombopénie doivent être corrigées (pH > 7,20, température > 35 °C, fibrinogène > 1, voire 2 g/L, plaquettes > 50 000/mm3).
Anticipation et orientation
La plupart des HPP sont imprévisibles, mais certaines situations à risque doivent être anticipées pour permettre la prise en charge des femmes dans un environnement au plateau technique optimal (chirurgie, radiologie, biologie, établissement sanguin, réanimation). C’est le cas, en particulier, des patientes présentant des anomalies d’insertion placentaire sévères (placenta accreta). Le transfert et la planification en antepartum en équipe pluridisciplinaire de l’accouchement de ces femmes dans des centres entraînés sont une nécessité.
Conclusion
La gestion d’une HPP est une situation de travail en équipe pendant laquelle chacun doit être au clair avec les gestes à effectuer sans laisser place à l’improvisation ou au manque de rigueur. Les modalités de prise en charge des HPP doivent être rédigées sous forme d’une procédure opérationnelle, adaptée aux conditions locales d’exercice, afin de prévenir les oublis et/ou les divergences qui sont souvent fréquents dans cette situation très stressante. Une feuille spécifique « hémorragie du post-partum », commune à l’équipe d’obstétrique et d’anesthésie-réanimation, s’avère également utile pour améliorer cette prise en charge conjointe.
Bibliographie
Les morts maternelles en France : mieux comprendre pour mieux prévenir. 5e rapport de l’Enquête nationale confidentielle sur les morts maternelles (ENCMM), 2010-2012. Saint-Maurice : Santé publique France, 2017. 230 p.
Hémorragie du post-partum. J Gynecol Obstet Biol Reprod (Paris) 2014 ; 43 : 931-1179.
Vous venez de lire la fiche 42 Hémorragie du post-partum de l’ouvrage Protocoles en anesthésie et analgésie obstétricales
© 2018, Elsevier Masson SAS. Tous droits réservés
auteurs
Publié sous l’égide du Club d’anesthésie-réanimation obstétricale (CARO)
Avec la collaboration de : G. Aya, F. Bayoumeu, D. Benhamou, F. Bolandard, M.-P. Bonnet, M. Bonnin, E. Boselli, L. Bouvet, F. Broisin, B. Bryssine, D. Chassard, H.-J. Clément, P.-Y. Dewandre, P. Diemunsch, A.-S. Ducloy, C. Fischer, V. Fuzier, H. Keita, E. Lopard, S. Malfroy, F. Mercier, E. Moreau, S. Nebout, S. Roger-Christoph, M. Ruivard, N. Sens, B. Storhe, F. Vial